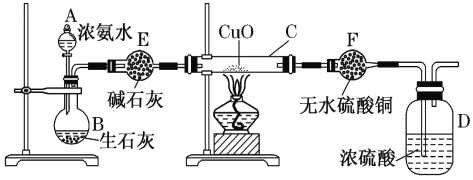
题目内容
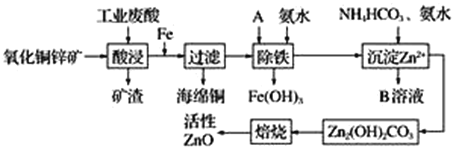
【题目】某科研小组设计出利用工业废酸(稀硫酸)来浸取某废弃的氧化铜锌矿的方案,实现废物综合利用,方案如图所示。
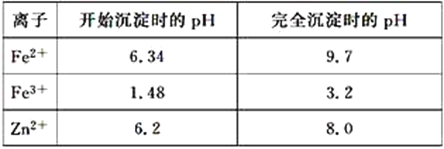
已知:各离子开始沉淀及完全沉淀时的pH如表所示:
请回答下列问题:
(1)在“酸浸”步骤中,为提高浸出速率,除通入空气“搅拌”外,还可采取的措施是(任写一点即可)____。
(2)物质A最好使用下列物质中的___(填选项序号)。
A.KMnO4 B.H2O2 C.HNO3
(3)除铁过程中加入氨水的目的是调节溶液的pH,pH应控制在____范围之间,写出生成氢氧化铁的离子方程式:_____。
(4)物质B可直接用作氮肥,则B的化学式是____。
(5)除铁后得到的氢氧化铁可用次氯酸钾溶液在碱性环境将其氧化得到一种高效的多功能处理剂(K2FeO4),写出该反应的离子方程式:____。
【答案】加热升高温度,或增大酸的浓度、将氧化铜锌矿粉碎等 B 3.2~6.2 2Fe2++4NH3H2O+H2O2=2Fe(OH)3↓+4NH4+ (NH4)2SO4 2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O
【解析】
氧化铜锌矿经废酸浸取后过滤,可以得到硫酸铜、硫酸锌溶液;向酸浸溶液中加铁可还原出铜,经过滤可得到铜和硫酸亚铁、硫酸锌的混合液;然后加入A和氨水,将亚铁离子转化为氢氧化铁沉淀而除去;后向滤液中加入氨水将锌离子转化为氢氧化锌,最后焙烧,碱式碳酸锌受热分解得到氧化锌,据以上分析进行解答。
(1)影响化学反应速率的因素很多,要提高氧化铜矿的酸浸速率,可采用的措施:升高温度、增大酸的浓度、将矿石粉碎等;
故答案是:加热升高温度,或增大酸的浓度、将氧化铜锌矿粉碎等;
(2)除铁过程中加入A和氨水,使亚铁离子变为氢氧化铁沉淀,故A应为氧化剂;且考虑加入A不引入新杂质,KMnO4做氧化剂引入杂质锰离子,HNO3做氧化剂的还原产物对环境有危害,还引入杂质硝酸根离子,而双氧水的还原产物为水,不引入新杂质,绿色的氧化剂;
故答案选B。
(3)从图表中数据可知,铁离子沉淀完全的pH为3.2,锌离子开始沉淀的pH为6.2,故除去铁的pH应控制在3.2~6.2 范围之间;硫酸亚铁溶液中加入双氧水、氨水后,发生氧化还原反应,生成氢氧化铁沉淀,离子方程式为:2Fe2++4NH3H2O+H2O2=2Fe(OH)3↓+4NH4+;
故答案是:3.2~6.2;2Fe2++4NH3H2O+H2O2=2Fe(OH)3↓+4NH4+;
(4)因为所用废酸为硫酸,B又可做氮肥,所以B为(NH4)2SO4;
故答案是:(NH4)2SO4;
(5)根据信息可知,氢氧化铁可用次氯酸钾溶液在碱性环境将其氧化为K2FeO4,反应的离子方程式:2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O;
故答案是:2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O。

 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案【题目】按如图装置进行实验,下列推断正确的是( )
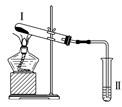
选项 | Ⅰ中试剂 | Ⅱ中试剂及现象 | 推断 |
A | 氯化铵 | 酚酞溶液不变红色 | 氯化铵稳定 |
B | 硫酸亚铁 | 品红溶液褪色 | FeSO4分解生成FeO和SO2 |
C | 涂有石蜡油的碎瓷片 | 酸性高锰酸钾溶液褪色 | 石蜡油发生了化学变化 |
D | 铁粉与水蒸气 | 肥皂水冒泡 | 铁粉与水蒸气发生了反应 |
A. A B. B C. C D. D