题目内容
【题目】铜、铁、铝是重要的金属材料,铜、铁、铝及其化合物有非常重要的用途。
(1)高铁酸钾(K2FeO4)是一种高效多功能水处理剂。湿法制备高铁酸钾(K2FeO4)的反应体系中有六种微粒:Fe(OH)3、ClO 、OH 、FeO42、Cl 、H2O。
①写出并配平湿法制高铁酸钾的离子反应方程式:________________________________。
②若反应过程中转移了 0.3mol 电子,则还原产物的物质的量为_______mol。
(2)以铝土矿(主要成分为Al2O3和Fe2O3、SiO2)为原料制备铝的一种工艺流程如下:
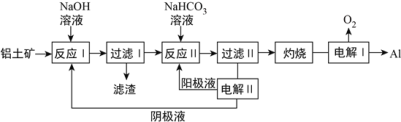
①滤渣主要成分为________。
②在实验室灼烧操作应选择的实验仪器为_________。
③反应II中,加入NaHCO3一段时间才有沉淀生成,写出加入少量NaHCO3时发生反应的离子方程式____________________________________。
(3)已知25 ℃时Ksp[Cu(OH)2]=2.2×1020,Ksp[Al(OH)3]=1.1×1033。在25 ℃下,向浓度均为0.1 mol·L1的AlCl3和CuCl2混合溶液中逐滴加入氨水,先生成_________沉淀(填化学式)。
(4)以含有少量硫酸的硫酸铜溶液为原料制备铜:a g铁粉与上述溶液完全反应后,得到a g铜,则参与反应的CuSO4与H2SO4的物质的量之比为___________。
【答案】2Fe(OH)3+3ClO +4OH =2FeO42+3Cl+5H2O 0.15 Fe2O3 坩埚 HCO3-+OH-=H2O+CO32- Al(OH)3 7:1
【解析】
(1)①湿法制备高铁酸钾(K2FeO4),则FeO42为产物,Fe(OH)3为反应物,化合价升高总共3价,由电子转移守恒可知,ClO为反应物,Cl为生成物,化合价降低共2将,化合价升降最小公倍数为6,故Fe(OH)3的系数为2,FeO42的系数为2,ClO的系数为3,Cl的系数为3,根据电荷守恒可知,OH为反应物,系数为4,由元素守恒可知H2O为生成物,其系数为5,离子方程式为:2Fe(OH)3+3ClO+4OH=2FeO42+3Cl+5H2O,
故答案为:2Fe(OH)3+3ClO+4OH=2FeO42+3Cl+5H2O;
②反应中Fe元素化合价变化由+3价升高为+6,故每生成1molFeO42转移电子1mol×(63)=3mol,由于还原产物为Cl,若反应过程中转移了0.3mol电子,则还原产物的物质的量为![]() =0.15mol,
=0.15mol,
故答案为:0.15mol.
(2)以铝土矿(主要成分为Al2O3和Fe2O3、SiO2)为原料制备铝,由流程可知,加NaOH溶解时Fe2O3不反应,由信息可知SiO2在“碱溶”时转化为铝硅酸钠沉淀,过滤得到的滤渣为Fe2O3;碳酸氢钠与偏铝酸钠反应生成Al(OH)3,过滤II得到Al(OH)3,灼烧生成氧化铝,电解I为电解氧化铝生成Al和氧气,电解II为电解Na2CO3溶液,结合图可知,阳极上碳酸根离子失去电子生成碳酸氢根离子和氧气,阴极上氢离子得到电子生成氢气,
①根据分析可知,滤渣的主要成分为Fe2O3,故答案为:Fe2O3;
②灼烧氢氧化铝固体需要在坩埚中进行,故答案为:坩埚;
③在溶解铝土矿时加入了过量的氢氧化钠溶液,则加入少量碳酸氢钠时,碳酸氢钠优先于氢氧化钠反应,该反应的离子方程式为:HCO3-+OH-=H2O+CO32-,故答案为:HCO3-+OH-=H2O+CO32-;
(3)在25℃下,向浓度均为0.1moL1的AlCl3和CuCl2混合溶液中逐滴加入氨水,由Ksp[Cu(OH)2]=2.2×1020,可知c(OH)=![]() =4.47×1010mol/L,由Ksp[Al(OH)3]
=4.47×1010mol/L,由Ksp[Al(OH)3]
=1.1×1033可知需要c(OH)=![]() =2.2×1011mol/L,铝离子转化为沉淀需要的c(OH)小,则Al(OH)3先沉淀,故答案为:Al(OH)3;
=2.2×1011mol/L,铝离子转化为沉淀需要的c(OH)小,则Al(OH)3先沉淀,故答案为:Al(OH)3;
(4)得到Cu的质量与Fe的质量相等,说明Fe与硫酸铜反应中固体增重等于与硫酸反应的Fe的质量,令与硫酸反应的Fe的质量为56g,则:
Fe+CuSO4═FeSO4+Cu 固体增重
1mol 64g-56g=8g
n(CuSO4) 56g
故n(CuSO4)= ![]() =7mol
=7mol
Fe+H2SO4═FeSO4+H2↑
56g 1mol
故参加反应的硫酸铜与硫酸的物质的量之比=7mol:1mol=7:1;
答案为:7:1

 名校课堂系列答案
名校课堂系列答案