题目内容
【题目】人体血液里Ca2+的浓度一般采用mg·cm-3来表示。抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用KMnO4溶液滴定即可测定血液样品中Ca2+的浓度。某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度。
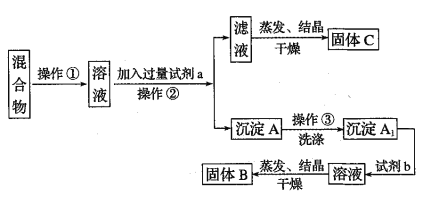
(配制KMnO4标准溶液)如图是配制50mL KMnO4标准溶液的过程示意图。
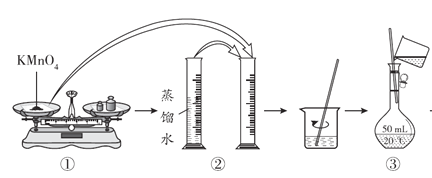
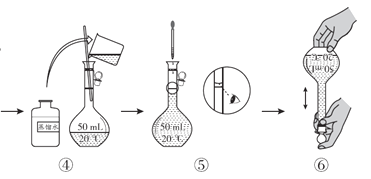
(1)请你观察图示判断,其中不正确的操作有__________(填序号)。
(2)如果用图示的操作配制溶液,所配制的溶液浓度将__________(填“偏大”或“偏小”)。
(测定血液样品中Ca2+的浓度)抽取血样20.00mL,经过上述处理后得到草酸,再用0.020mol·L-1 KMnO4溶液滴定,使草酸转化成CO2逸出,这时共消耗12.00mL KMnO4溶液。
(3)已知草酸跟KMnO4溶液反应的离子方程式为2MnO4-+5H2C2O4+6H+=2Mnx++10CO2↑+8H2O则方程式中的x=__________。
(4)经过计算,血液样品中Ca2+的浓度为__________mg·cm-3。
【答案】②⑤ 偏小 2 1.2
【解析】
(1)根据图示分析配制一定物质的量浓度的溶液的操作正误;
(2)根据仰视刻度线,会使溶液体积偏大判断;
(3)根据电荷守恒进行分析;
(4)根据滴定数据及钙离子与高锰酸钾的关系式计算出血液样品中Ca2+的浓度。
(1)由图示可知②⑤操作不正确,②不能在量筒中溶解固体,⑤定容时应平视刻度线,至溶液凹液面与刻度线相切;
(2)如果用图示的操作配制溶液,由于仰视刻度线,会使溶液体积偏大,所配制的溶液浓度将偏小;
(3)根据电荷守恒,(-1×2)+(+1×6)=+x×2,解得,x=2,草酸跟KMnO4反应的离子方程式为:2MnO4-+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O;
(4)血样20.00mL经过上述处理后得到草酸,草酸消耗的消耗的高锰酸钾的物质的量为:0.020mol/L×0.012L=2.4×10-4mol,根据反应方程式2MnO4-+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O,及草酸钙的化学式CaC2O4,可知:n(Ca2+)=n(H2C2O4)=![]() n(MnO4-)=2.5×2.4×10-4mol=6×10-4mol,Ca2+的质量为:40g/mol×6×10-4mol=0.024g=24mg,钙离子的浓度为:
n(MnO4-)=2.5×2.4×10-4mol=6×10-4mol,Ca2+的质量为:40g/mol×6×10-4mol=0.024g=24mg,钙离子的浓度为:![]() =1.2mg/cm3。
=1.2mg/cm3。

【题目】钠及其化合物具有广泛的用途。
(1)常温下,浓度均为0.1 mol/L的下列五种钠盐溶液的pH如表所示:
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
上述几种钠盐的阴离子,结合氢离子能力最强的是______(填离子符号),根据表中数据,将浓度均为0.01mol/L的下列四种溶液分别稀释100倍,pH变化最大的是______.(填字母)。
A.HCN B.HClO C.CH3COOH D.H2CO3
(2)已知几种离子开始沉淀时溶液的pH如下表所示:
离子 | Fe2+ | Cu2+ | Mg2+ |
pH | 7.6 | 5.2 | 10.4 |
当向含有相同浓度的Cu2+、Mg2+、Fe2+的溶液中滴加氢氧化钠溶液时,________(填离子符号)先沉淀;Ksp[Fe(OH)2]______(填“>”“=”或“<”)Ksp[Mg(OH)2];要使0.2 mol/L的硫酸铜溶液中铜离子沉淀较为完全(使铜离子的浓度降至原来的千分之一),则应向溶液中加入氢氧化钠溶液使溶液pH=_______。{Cu(OH)2的Ksp=2×10-20。}