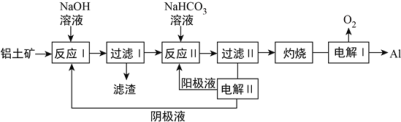
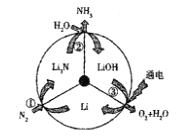
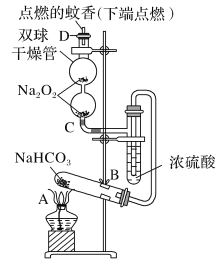
题目内容
【题目】汽车剧烈碰撞时,安全气囊中发生反应 10NaN3+2KNO3 =K2O+5X+16N2↑,下列说 法不正确的是( )
A.X 的化学式为 Na2O
B.上述反应中 NaN3 被氧化,KNO3 发生还原反应
C.每生成 1.6molN2,则转移的电子为 3 mol
D.若被氧化的 N 原子的物质的量为 3mol,则氧化产物比还原产物多 1.4 mol
【答案】C
【解析】
A.根据原子守恒可知,生成物中缺少10个Na,5个O,而X粒子有5个,所以X的化学式为Na2O,故A正确;
B. NaN3 中钠元素化合价为+1价,氮元素的化合价为-![]() ,发生反应后,氮元素的化合价由-
,发生反应后,氮元素的化合价由-![]() 价升高到0价,NaN3被氧化,发生氧化反应;而KNO3 中+5价氮,降低到0价,发生还原反应,故B正确;
价升高到0价,NaN3被氧化,发生氧化反应;而KNO3 中+5价氮,降低到0价,发生还原反应,故B正确;
C.根据方程式可知,2KNO3→N2,化合价降低10,即2molKNO3参与反应转移电子物质的量为10mol,生成16molN2,则每生成1.6molN2,则转移的电子为 1 mol,故C错误;
D.根据方程式可知,生成16molN2,转移电子的物质的量为10mol,被氧化的氮原子有30mol,被还原的N原子有2mol,因此氧化产物(氮气)比还原产物(氮气)多(15mol-1mol)=14mol;若被氧化的 N 原子的物质的量为 3mol,则氧化产物比还原产物多 1.4 mol,故D正确;
故答案选C。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】钠及其化合物具有广泛的用途。
(1)常温下,浓度均为0.1 mol/L的下列五种钠盐溶液的pH如表所示:
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
上述几种钠盐的阴离子,结合氢离子能力最强的是______(填离子符号),根据表中数据,将浓度均为0.01mol/L的下列四种溶液分别稀释100倍,pH变化最大的是______.(填字母)。
A.HCN B.HClO C.CH3COOH D.H2CO3
(2)已知几种离子开始沉淀时溶液的pH如下表所示:
离子 | Fe2+ | Cu2+ | Mg2+ |
pH | 7.6 | 5.2 | 10.4 |
当向含有相同浓度的Cu2+、Mg2+、Fe2+的溶液中滴加氢氧化钠溶液时,________(填离子符号)先沉淀;Ksp[Fe(OH)2]______(填“>”“=”或“<”)Ksp[Mg(OH)2];要使0.2 mol/L的硫酸铜溶液中铜离子沉淀较为完全(使铜离子的浓度降至原来的千分之一),则应向溶液中加入氢氧化钠溶液使溶液pH=_______。{Cu(OH)2的Ksp=2×10-20。}