题目内容
10.检验无水乙醇中是否有水的方法是( )| A. | 加金属钠 | B. | 加入无水硫酸铜 | C. | 加热蒸馏 | D. | 加无水氯化钙 |
分析 检验乙醇中是否含有水可用无水硫酸铜,现象是固体变为蓝色,不能用钠,乙醇和水都反应生成氢气.
解答 解:A.乙醇和水都反应生成氢气,不能鉴别,故A错误;
B.加入无水硫酸铜,如含有水,固体变为蓝色,可鉴别,故B正确;
C.加热蒸馏,无论是否有水,都没有明显的现象,且操作复杂,故C错误;
D.加无水氯化钙没有明显现象,且乙醇也可被氯化钙吸收,不能检验,故D错误.
故选B.
点评 本题考查物质的检验和鉴别,题目难度不大,注意把握物质性质的异同,根据物质的性质选择检验试剂,注意现象要明显.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
1.某化学小组进行了硫代硫酸钠(Na2S2O3)的探究,首先通过查阅资料得到如下信息:a.Na2S2O3、BaS2O3均易溶于水;b.Na2S2O3晶体在空气中易被氧化.然后进行如下实验: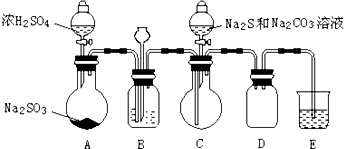
【实验一】硫代硫酸钠(Na2S2O3)的制取实验室制备装置如图所示(夹持装置已省略):
回答问题:
(1)①装置B中的长颈漏斗的作用是平衡压强.
②B中最好盛装的液体是c.
a.蒸馏水 b.饱和Na2SO3溶液 c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
(2)在装置C中有Na2S2O3生成.
①写出装置C中反应的化学方程式:2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2
②结束反应后,取C中溶液,经蒸发浓缩、冷却结晶、过滤洗涤、干燥,得到Na2S2O3•5H2O.
(3)装置E中为NaOH溶液.
【实验二】硫代硫酸钠(Na2S2O3)的性质
(4)Na2S2O3在酸性溶液中不能稳定存在.请用离子方程式表示该过程:2H++S2O32-=SO2↑+S↓+H2O
(5)如何检验Na2S2O3晶体在空气中已被氧化?少量Na2S2O3晶体于试管中,加适量水溶解,滴加少量的氯化钡溶液,如有白色沉淀生成,说明已被氧化.
【实验三】用Na2S2O3测定废水中的Ba2+
(6)工业上常用Na2S2O3溶液测定废水中Ba2+的浓度,步骤如下:取废水25.00mL,控制适当的酸度加入足量 K2Cr2O7溶液,得BaCrO4沉淀;过滤、洗涤后,用适量稀盐酸溶解,此时CrO42-全部转化为Cr2O72-;再加过KI溶液,充分反应后得混合溶液V mL,将其平均分成4等份,加入淀粉溶液作指示剂,用0.001 00mol•L-1 的Na2S2O3溶液进行滴定,反应完全时,相关数据记录如表所示:
部分反应离子方程式为:
Cr2O72-+6I-+14H+═2Cr3++3I2+7H2O;
I2+2S2O32-═2I-+S4O64-.
①判断达到滴定终点的现象是滴加最后一滴Na2S2O3标准液时溶液由蓝色变为无色且半分钟内不变色,
②计算废水中Ba2+的物质的量浓度9.6×10-4mol•L-1.

【实验一】硫代硫酸钠(Na2S2O3)的制取实验室制备装置如图所示(夹持装置已省略):
回答问题:
(1)①装置B中的长颈漏斗的作用是平衡压强.
②B中最好盛装的液体是c.
a.蒸馏水 b.饱和Na2SO3溶液 c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
(2)在装置C中有Na2S2O3生成.
①写出装置C中反应的化学方程式:2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2
②结束反应后,取C中溶液,经蒸发浓缩、冷却结晶、过滤洗涤、干燥,得到Na2S2O3•5H2O.
(3)装置E中为NaOH溶液.
【实验二】硫代硫酸钠(Na2S2O3)的性质
(4)Na2S2O3在酸性溶液中不能稳定存在.请用离子方程式表示该过程:2H++S2O32-=SO2↑+S↓+H2O
(5)如何检验Na2S2O3晶体在空气中已被氧化?少量Na2S2O3晶体于试管中,加适量水溶解,滴加少量的氯化钡溶液,如有白色沉淀生成,说明已被氧化.
【实验三】用Na2S2O3测定废水中的Ba2+
(6)工业上常用Na2S2O3溶液测定废水中Ba2+的浓度,步骤如下:取废水25.00mL,控制适当的酸度加入足量 K2Cr2O7溶液,得BaCrO4沉淀;过滤、洗涤后,用适量稀盐酸溶解,此时CrO42-全部转化为Cr2O72-;再加过KI溶液,充分反应后得混合溶液V mL,将其平均分成4等份,加入淀粉溶液作指示剂,用0.001 00mol•L-1 的Na2S2O3溶液进行滴定,反应完全时,相关数据记录如表所示:
| 实验编号 | 1 | 2 | 3 | 4 |
| 消耗Na2S2O3标准 溶液的体积/mL | 18.02 | 17.98 | 18.00 | 20.03 |
Cr2O72-+6I-+14H+═2Cr3++3I2+7H2O;
I2+2S2O32-═2I-+S4O64-.
①判断达到滴定终点的现象是滴加最后一滴Na2S2O3标准液时溶液由蓝色变为无色且半分钟内不变色,
②计算废水中Ba2+的物质的量浓度9.6×10-4mol•L-1.
18.在同温同压下,下列各组热化学方程式中,△H1>△H2的是( )
| A. | 2H2(气)+O2(气)═2H2O(气)△H1 2H2(气)+O2(气)═2H2O(液)△H2 | |
| B. | S(气)+O2(气)═SO2(气)△H1 S(固)+O2(气)═SO2(气)△H2 | |
| C. | C(固)+O2(气)═CO2(气)△H1 C(固)+$\frac{1}{2}$O2 (气)═CO(气)△H2 | |
| D. | H2(气)+Cl2(气)═2HCl(气)△H1 $\frac{1}{2}$H2(气)+$\frac{1}{2}$Cl2(气)═HCl(气)△H2 |
5.化学与科技、社会、生活、生产密切结合,下列有关说法不正确的是( )
| A. | “乙醇汽油”的广泛使用能有效减少有害气体的排放 | |
| B. | 误食重金属盐而引起的中毒,急救方法是服用大量的豆浆或牛奶 | |
| C. | “无氟冰箱”取代“含氟冰箱”,对人类的保护伞一臭氧层起到保护作用 | |
| D. | “海水淡化”可以解决“淡水供应危机”,向海水中加人净水剂明矾可以使海水淡化 |
20.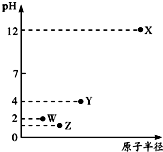 第三周期元素X、Y、Z、W的最高价氧化物溶于水可得四种溶液,0.01mol/L的这四种溶液pH与该元素原子半径的关系如图所示.下列说法正确的是( )
第三周期元素X、Y、Z、W的最高价氧化物溶于水可得四种溶液,0.01mol/L的这四种溶液pH与该元素原子半径的关系如图所示.下列说法正确的是( )
 第三周期元素X、Y、Z、W的最高价氧化物溶于水可得四种溶液,0.01mol/L的这四种溶液pH与该元素原子半径的关系如图所示.下列说法正确的是( )
第三周期元素X、Y、Z、W的最高价氧化物溶于水可得四种溶液,0.01mol/L的这四种溶液pH与该元素原子半径的关系如图所示.下列说法正确的是( )| A. | 简单离子半径:X>Y>Z>W | |
| B. | Y与W形成的化合物分子可能是非极性分子 | |
| C. | 基态原子的第一电离能:W>Z>Y>X | |
| D. | X和Y的最高价氧化物对应的水化物恰好中和时,溶液呈中性 |
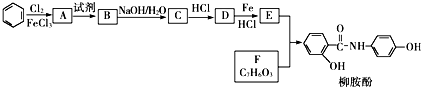
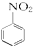 $→_{HCl}^{Fe}$
$→_{HCl}^{Fe}$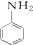
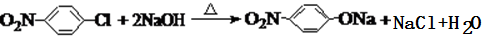 .
.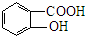 .
. 、
、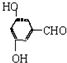 、
、 (写出2种).
(写出2种).