题目内容
20. 第三周期元素X、Y、Z、W的最高价氧化物溶于水可得四种溶液,0.01mol/L的这四种溶液pH与该元素原子半径的关系如图所示.下列说法正确的是( )
第三周期元素X、Y、Z、W的最高价氧化物溶于水可得四种溶液,0.01mol/L的这四种溶液pH与该元素原子半径的关系如图所示.下列说法正确的是( )| A. | 简单离子半径:X>Y>Z>W | |
| B. | Y与W形成的化合物分子可能是非极性分子 | |
| C. | 基态原子的第一电离能:W>Z>Y>X | |
| D. | X和Y的最高价氧化物对应的水化物恰好中和时,溶液呈中性 |
分析 第三周期元素中,X最高价氧化物水化物的溶液pH为12,氢氧根浓度为0.01mol/L,故为一元强碱,则X为Na;Y、W、Z对应的最高价氧化物水化物的溶液pH均小于7,均为酸,W最高价含氧酸溶液中氢离子浓度为0.01mol/L,故为一元强酸,则W为Cl元素;最高价含氧酸中,Z对应的酸性比W的强、Y对应的酸性比W的弱,而原子半径Y>Z>Cl,硅酸不溶于水,故Z为S元素,Y为P元素,以此解答该题.
解答 解:第三周期元素中,X最高价氧化物水化物的溶液pH为12,氢氧根浓度为0.01mol/L,故为一元强碱,则X为Na;Y、W、Z对应的最高价氧化物水化物的溶液pH均小于7,均为酸,W最高价含氧酸溶液中氢离子浓度为0.01mol/L,故为一元强酸,则W为Cl元素;最高价含氧酸中,Z对应的酸性比W的强、Y对应的酸性比W的弱,而原子半径Y>Z>Cl,硅酸不溶于水,故Z为S元素,Y为P元素,
A.电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径P3->S2->Cl->Na+,故A错误;
B.Y与W形成的化合物分子PCl5,结构对称,不存在孤对电子,正负电荷重心重叠,是非极性分子,故B正确;
C.P最外层为半充满结构,性质稳定,难以失去电子,第一电离能大于S元素,故C错误;
D.X和Y的最高价氧化物对应的水化物分别为NaOH、磷酸,恰好中和生成磷酸钠,溶液中磷酸根水解,溶液呈碱性,故D错误,
故选B.
点评 本题考查结构性质位置关系应用,根据酸性、原子半径推断元素是解题关键,侧重对元素周期律的考查,难度中等.

练习册系列答案
 课课优能力培优100分系列答案
课课优能力培优100分系列答案 优百分课时互动系列答案
优百分课时互动系列答案
相关题目
10.检验无水乙醇中是否有水的方法是( )
| A. | 加金属钠 | B. | 加入无水硫酸铜 | C. | 加热蒸馏 | D. | 加无水氯化钙 |
11.下列有机物中属于苯的同系物的是( )
| A. | 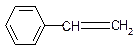 | B. | 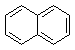 | C. | 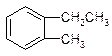 | D. | 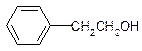 |
8.卤代烃能发生下列反应:2CH3CH2Br+2Na→CH3CH2CH2CH3+2NaBr,下列有机物可以合成环丁烷的是( )
| A. | CH3CH2CH2CH2Br | B. | CH3CH2CHBrCH2CH2Br | ||
| C. | CH2BrCH2CH2CH2Br | D. | CH3CHBrCH2CH2CH2Br |
15.下列物质在生活中应用时,起还原作用的是( )
| A. | 明矾作净水剂 | B. | 甘油作护肤保湿剂 | ||
| C. | 84消毒液作消毒剂 | D. | 铁粉作食品袋内的脱氧剂 |
12.草木灰中含有可溶性钾盐(主要成分是K2SO4、K2CO3、KCl).某学生按下列操作提取草木灰中的钾盐:①取草木灰加水溶解;②过滤、取滤液;③蒸发滤液;④冷却结晶.
(1)为检验草木灰中的离子,取少量晶体溶于水,并把溶液分成四份,完成以下实验报告(在横线上填写相关的内容):
(2)步骤Ⅲ所得的结论,你认为是否正确?否(填“是”或“否”);为什么?引入氯离子,应将氯化钡改为硝酸钡
(3)写出步骤Ⅱ有关现象的化学方程式K2SO4+BaCl2=BaSO4↓+2KCl.
(1)为检验草木灰中的离子,取少量晶体溶于水,并把溶液分成四份,完成以下实验报告(在横线上填写相关的内容):
| 实验步骤 | 实验现象 | 实验结论 |
Ⅰ.取第一份溶液和适量稀盐酸加入下列装置的试管中,把澄清的石灰水加入烧杯中 | 气泡产生,澄 清的石灰水变浑浊 | 证明含有碳酸根离子 |
| Ⅱ.取第二份溶液,分别滴加稀盐酸和氯化钡 | 白色沉淀 | 证明含有硫酸根离子 |
| Ⅲ.取第三份溶液加入过量BaCl2溶液,过滤,除去SO42-和CO32-,再滴加AgNO3溶液和稀硝酸 | 有白色沉淀生成生成 | 证明含有氯离子 |
| Ⅳ.取第四份溶液进行焰色反应 | 透过蓝色钴玻璃 火焰呈紫色 | 证明含有K+ |
(3)写出步骤Ⅱ有关现象的化学方程式K2SO4+BaCl2=BaSO4↓+2KCl.
