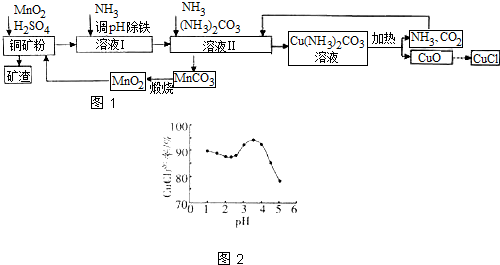
题目内容
2.某无色气体可能由CO2、HCl、NH3、NO2、NO、H2中的一种或几种组成,该无色气体通过盛有浓硫酸的洗气瓶后,气体体积减少;使剩余气体通过装有过氧化钠的干燥管后,得到红棕色气体;再将红棕色气体通入盛满水且倒立在水槽中的试管内,最终液体充满试管.由此可以推断:(1)原气体一定含有NH3、NO、CO2;
(2)原气体一定不含有HCl、NO2、H2;
(3)由最终结果可知,原气体中CO2 和NO 的体积比为3:2
(以上现象均在相同状况下观察).
分析 气体无色排除二氧化氮,该无色气体通过盛有浓硫酸的洗气瓶后,气体体积减少,说明能够与浓硫酸反应,一定有氨气,不含氯化氢,使剩余气体通过装有过氧化钠的干燥管后,得到红棕色气体,说明一定有二氧化碳、一氧化氮,再将红棕色气体通入盛满水且倒立在水槽中的试管内,最终液体充满试管,说明一点没有氢气,据此解答.
解答 解:气体无色排除二氧化氮,该无色气体通过盛有浓硫酸的洗气瓶后,气体体积减少,说明能够与浓硫酸反应,一定有氨气,不含氯化氢,使剩余气体通过装有过氧化钠的干燥管后,得到红棕色气体,说明一定有二氧化碳、一氧化氮,再将红棕色气体通入盛满水且倒立在水槽中的试管内,最终液体充满试管,说明一点没有氢气,
所以一定有的气体为:NH3、NO、CO2;
一定没有的气体为:HCl、NO2、H2;
(1)一定有的气体为:NH3、NO、CO2;
故答案为:NH3、NO、CO2(2分)
(2)一定没有的气体为:HCl、NO2、H2;
故答案为:HCl、NO2、H2;
(3)CO2和过氧化钠反应生成氧气,氧气和NO反应生成红棕色气体NO2,氧气和二氧化氮与水完全反应生成硝酸,发生4NO2+O2+2H2O=4HNO3,设有4molNO2,则应有4molNO,反应2NO+O2=2N02和4NO2+O2+2H2O=4HNO3共需要氧气为:2mol+1mol=3mol,二氧化碳的物质的量:6mol,
则n(CO2):n(NO)=6:4=3:2,
故答案为:CO2、NO;3:2.
点评 本题考查混合气体的组成判断,明确常见气体的性质是解题关键,题目难度不大.

练习册系列答案
相关题目
13.已知合成氨反应N2(g)+3H2(g)?2NH3(g)△H<0.
(1)该反应的化学平衡常数表达式是K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})•{c}^{3}({H}_{2})}$.
(2)该反应的化学平衡常数K与温度T的关系如下表所示:
其中,K1> K2(填“>”、“=”或“<”).
(3)合成氨在农业和国防中有很重要的意义,在实际工业生产中,常采用下列措施,其中可以用勒夏特列原理解释的是BD(填字母).
A.用铁触媒加快化学反应速率 B.采用较高压强(20MPa~50MPa)
C.采用较高温度(400℃~500℃) D.将生成的氨液化并及时从体系中分离出来.
(1)该反应的化学平衡常数表达式是K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})•{c}^{3}({H}_{2})}$.
(2)该反应的化学平衡常数K与温度T的关系如下表所示:
| T/K | 473 | 573 | 673 | … |
| K | 4.4×10-2 | K1 | K2 | … |
(3)合成氨在农业和国防中有很重要的意义,在实际工业生产中,常采用下列措施,其中可以用勒夏特列原理解释的是BD(填字母).
A.用铁触媒加快化学反应速率 B.采用较高压强(20MPa~50MPa)
C.采用较高温度(400℃~500℃) D.将生成的氨液化并及时从体系中分离出来.
10.检验无水乙醇中是否有水的方法是( )
| A. | 加金属钠 | B. | 加入无水硫酸铜 | C. | 加热蒸馏 | D. | 加无水氯化钙 |
17.下列说法不正确的是( )
| A. | 水晶有固定的熔点,而普通玻璃则没有 | |
| B. | 水泥、玻璃、陶瓷属于传统的无机非金属材料 | |
| C. | 不锈钢和普通钢的组成元素完全相同,但耐腐蚀性能不同 | |
| D. | 氯化铵和单质碘在加热时有类似现象,但本质不同 |
14.下列说法错误的是( )
| A. | 分解反应可能是氧化还原反应 | B. | 置换反应一定是氧化还原反应 | ||
| C. | 复分解反应不属于氧化还原反应 | D. | 化合反应一定是氧化还原反应 |
11.下列有机物中属于苯的同系物的是( )
| A. |  | B. | 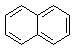 | C. | 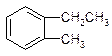 | D. | 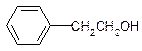 |
12.草木灰中含有可溶性钾盐(主要成分是K2SO4、K2CO3、KCl).某学生按下列操作提取草木灰中的钾盐:①取草木灰加水溶解;②过滤、取滤液;③蒸发滤液;④冷却结晶.
(1)为检验草木灰中的离子,取少量晶体溶于水,并把溶液分成四份,完成以下实验报告(在横线上填写相关的内容):
(2)步骤Ⅲ所得的结论,你认为是否正确?否(填“是”或“否”);为什么?引入氯离子,应将氯化钡改为硝酸钡
(3)写出步骤Ⅱ有关现象的化学方程式K2SO4+BaCl2=BaSO4↓+2KCl.
(1)为检验草木灰中的离子,取少量晶体溶于水,并把溶液分成四份,完成以下实验报告(在横线上填写相关的内容):
| 实验步骤 | 实验现象 | 实验结论 |
Ⅰ.取第一份溶液和适量稀盐酸加入下列装置的试管中,把澄清的石灰水加入烧杯中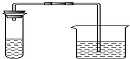 | 气泡产生,澄 清的石灰水变浑浊 | 证明含有碳酸根离子 |
| Ⅱ.取第二份溶液,分别滴加稀盐酸和氯化钡 | 白色沉淀 | 证明含有硫酸根离子 |
| Ⅲ.取第三份溶液加入过量BaCl2溶液,过滤,除去SO42-和CO32-,再滴加AgNO3溶液和稀硝酸 | 有白色沉淀生成生成 | 证明含有氯离子 |
| Ⅳ.取第四份溶液进行焰色反应 | 透过蓝色钴玻璃 火焰呈紫色 | 证明含有K+ |
(3)写出步骤Ⅱ有关现象的化学方程式K2SO4+BaCl2=BaSO4↓+2KCl.