��Ŀ����
����Ŀ��ij��Һ�п��ܺ���H+��Fe2+��Mg2+��Cu2+��NH4+��A13+��OH-��SO42- �е�һ�ֻ��֡�������һ�ֵ���ɫ���岢������Һʱ���д̼�����ζ������ų��Ͱ�ɫ�������������뵭��ɫ��������ʵ���(������)�����������Ͳ�����������ʵ���(������)�Ĺ�ϵ����ͼ��ʾ������д���пհ�:
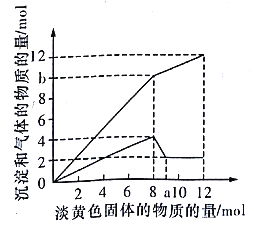
��1��ͼ��a���ֵ��__________�����ӵĵ���ɫ������_________ (�ѧʽ)��
��2������Һ�к��е�������_________��
��3����μ�����Һ�д��ڵ�������? _________��
���𰸡� 9 Na2O2 Mg2+��Al3+��NH4+��SO42- �ȼ�ϡ�������������������ټ��Ȼ�����Һ���а�ɫ��������
������������ɫ���������Һ�У���������Һʱ���д̼�������ų��Ͱ�ɫ�������ɣ���ɫ����ΪNa2O2��ͼ��ʵ��Ϊ����ͼ����һ�𣬽��ϵ������壬���µ��dz�����ͼ���м���8mol�������ƺ�ɫ������С����û����ȫ�ܽ⣬����Һ��һ��û��Fe2+��Cu2+��һ����NH4+��Al3+��Mg2+����Һ�б�����������ӣ�ֻ����SO42-������8mol��������֮�����������С��˵������8mol��������ʱ��笠�������ȫ��Ӧ��ֻ�ų�������
(1)���������֪��n(Mg2+)=n[Mg(OH)2]=2mol��n(Al3+)=4mol-n[Mg(OH)2]=2mol����2mol���������ܽ�ֻ��Ҫ2mol�������ƣ���1mol�������ƣ����a=9��������������֪������ɫ����Ϊ��Na2O2���ʴ�Ϊ��9��Na2O2��
(2)����������������Һ�к��е�������Mg2+��Al3+��NH4+��SO42-���ʴ�Ϊ��Mg2+��Al3+��NH4+��SO42-��
(3)������������ӿ�������Һ���ȼ�ϡ���ᣬ�����������ټ��Ȼ�����Һ���а�ɫ�����������ʴ�Ϊ���ȼ�ϡ���ᣬ�����������ټ��Ȼ�����Һ���а�ɫ����������

 �ִʾ��ƪϵ�д�
�ִʾ��ƪϵ�д�����Ŀ��ij�¶��£���Ӧ��2A��g��B��g��+C��g����ƽ�ⳣ��Ϊ1�����ݻ�Ϊ2L���ܱ������м���A��g����20sʱ��ø���ֵ����ʵ������±�������˵����ȷ���ǣ� ��
���� | A��g�� | B��g�� | C��g�� |
���ʵ���/mol | 1.2 | 0.6 | 0.6 |
A.��Ӧǰ20 s�ڵ�ƽ����Ӧ����Ϊv��A��=0.6 molL��1s��1
B.20 sʱ������Ӧ���ʴ����淴Ӧ����
C.�ﵽƽ��ʱ��A��g����ת����Ϊ100%
D.�������¶�ƽ�ⳣ����Ϊ2����Ӧ�ġ�H��0