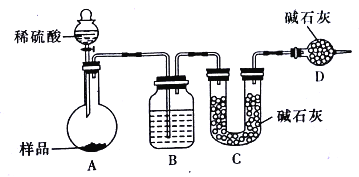
��Ŀ����
����Ŀ����һ���¶��µ�2L�̶��ݻ����ܱ������У�ͨ��2mol CO2��3mol H2 �� �����ķ�ӦΪCO2��g��+3H2��g��CH3OH��g��+H2O��g����H=��akJmol��1��a��0�������CO2��g����CH3OH��g����Ũ����ʱ��仯��ͼ��ʾ��
����˵���÷�Ӧ�Ѵ�ƽ��״̬���������ţ���
A����λʱ����ÿ����1.2mol H2 �� ͬʱ����0.4mol H2O
B��CO2����������ڻ�������б��ֲ���
C����������ƽ����Է�����������ʱ��ı仯���仯
D������ϵ��H2O��CH3OH�����ʵ���Ũ��֮��Ϊ1��1���ұ��ֲ���
����ҪʹK=1����ı����������������ѡ���
A������ѹǿ B����Сѹǿ C�������¶� D�������¶� E�����������
���𰸡�BC��D
���������⣺��A�����۷�Ӧ�Ƿ�ﵽƽ��״̬�����ڵ�λʱ����ÿ����1.2mol H2 �� ͬʱ����0.4mol H2O�����Բ��ܾݴ��ж�ƽ��״̬���ʴ��� B��CO2����������ڻ�������б��ֲ���ʱ�����淴Ӧ������ȣ���Ӧ�ﵽƽ��״̬������ȷ�� C����Ӧǰ������������ʵ�����С����������������䣬���Է�Ӧǰ��������ƽ����Է�������������������ƽ����Է�����������ʱ��ı仯���仯ʱ�����淴Ӧ������ȣ���Ӧ�ﵽƽ��״̬������ȷ�� D�����۷�Ӧ�Ƿ�ƽ�ⶼ���ڸ���ϵ��H2O��CH3OH�����ʵ���Ũ��֮��Ϊ1��1���ұ��ֲ��䣬���Բ��ܾݴ��ж�ƽ��״̬���ʴ���
��ѡBC���ڿ�ʼc��CO2��= ![]() =1mol/L��c��H2��=
=1mol/L��c��H2��= ![]() =1.5mol/L��
=1.5mol/L��
����ʽ��
CO2��g��+ | 3H2��g�� | CH3OH��g��+ | H2O��g�� | ||
��ʼ��mol/L�� | 1 | 1.5 | 0 | 0 | |
��Ӧ��mol/L�� | 0.25 | 0.75 | 0.25 | 0.25 | |
ƽ�⣨mol/L�� | 0.75 | 0.75 | 0.25 | 0.25 |
��ѧƽ�ⳣ��K= ![]() =
= ![]() ��
��
��ѧƽ�ⳣ��ֻ���¶��йأ�Ҫ�ı仯ѧƽ�ⳣ��ֻ�ܸı��¶ȣ��÷�Ӧ����Ӧ�Ƿ��ȷ�Ӧ��Ҫʹƽ�ⳣ������Ӧ�ý����¶ȣ���ѡD��
�����㾫�������ڱ��⿼��Ļ�ѧƽ��״̬���жϣ���Ҫ�˽�״̬�жϣ���v(B��)=v(B��)��v(C��):v(D��)=x : y��c(C)��C%��n(C)%�Ȳ������A��B��C��DΪ���壬��m+n��x+y��ѹǿ�㶨����ϵ��ɫ�����λʱ����ij�����ڻ�ѧ���Ķ����������γ�������ϵƽ��ʽ���㶨��m+n �� x+y���Ȳ��ܵó���ȷ�𰸣�

 Ӣ�żƻ���ĩ����ϵ�д�
Ӣ�żƻ���ĩ����ϵ�д�