��Ŀ����
����Ŀ��п��һ�ֹ��ɽ�������۳�������ɫ�����ִ���ҵ�ж��ڵ���������в���ĥ��ĵ�λ���ִ���п�ķ����ɷ�Ϊ��ʪ�������࣮����Ǧ������п�ĸ���Ʒ��
��1������п�ǽ���п����Ҫ��ZnS��ͨ����ѡ������ʹ��ת��Ϊ����п���ٰ�����п�ͽ�̿��ϣ��ڹķ�¯�м�����1473��1573K��ʹп�������������п����ʹ��ת��Ϊ����п����Ҫ��ѧ��Ӧ����ʽΪ ��
��2��ij��п�����Ҫ�ɷ�ΪZnS����������FeS�������ɷ֣�������Ϊԭ��ұ��п�Ĺ���������ͼ��ʾ�� 
�ش��������⣺
�ٱ��չ����в����ĺ��������ɾ������ᣬ��������ں�����������
�ڽ���Һ�������������м������Ҫ����Ϊп�ۣ��������� ��
�۸Ľ���пұ�����գ������ˡ���ѹ�������ȫʪ�����̣���ʡ�������¿�����Ⱦ�ı��չ��̣��ֿɻ��һ���й�ҵ��ֵ�ķǽ������ʣ�����ѹ������з�������Ҫ��Ӧ�����ӷ���ʽΪ
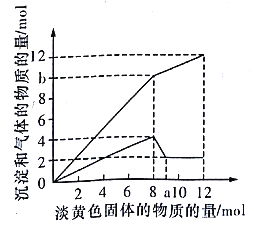
��3����ҵұ��п�Ĺ����У������Ǧ��������Ҫ�ɷ���PbO��Pb������������Ag��Zn��CaO��������������������ʣ���ij����С���о�����Ǧ������������Ǧ���������£� 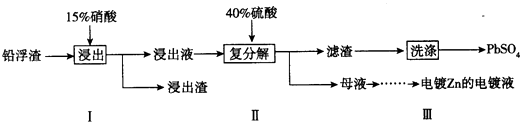
��֪��25��ʱ��Ksp��CaSO4��=4.9��10��5 �� KSP��PbSO4��=1.6��10��8 ��
����֪�������NO�������������Һ�к���������������Pb2+ �� д��Pb�μӷ�Ӧ�Ļ�ѧ����ʽ
�ڲ���������Pb��������ʹPb����ʣ�࣬Ŀ���� �� ��ƷPbSO4������Pb��NO3��2��Һ���ϴ�ӣ�Ŀ���� ��
��ĸҺ�п�ѭ�����õ����ʵĻ�ѧʽ������һ�����ʣ���ĸҺ���������ɵõ��Znʱ�������Һ���������϶�пʱ����������Ϊ ��
��4����п�����һ�ֳ�����أ���ص��ܷ�ӦʽΪ��Ag2O+Zn+H2O=2Ag+Zn��OH��2 �� �������ҺΪKOH��Һ����ع���ʱ�����ĵ缫ʽΪ ��
���𰸡�
��1��2ZnS+3O2 ![]() 2ZnO+2SO2
2ZnO+2SO2
��2���������û���Fe�ȣ��Դﵽ������Ŀ�ģ�2ZnS+4H++O2=2Zn2++2S��+2H2O
��3��3Pb+8HNO3=3Pb��NO3��2+2NO��+4H2O����ֹAg���ܽ������Һ����ʹAg���ڽ������У�����ȥ����������Ǧ�������������ƣ�HNO3��Zn��п
��4��Ag2O+H2O+2e���T2Ag+2OH��
���������⣺��1����������Ϣ��֪����п����Ҫ�ɷ���ZnS��ͨ����ѡ����ʹ��ת��Ϊ����п����Ӧ�Ļ�ѧ����ʽΪ��2ZnS+3O2 ![]() 2ZnO+2SO2�����Դ��ǣ�2ZnS+3O2
2ZnO+2SO2�����Դ��ǣ�2ZnS+3O2 ![]() 2ZnO+2SO2����2����ZnS������ȼ�շ���������ԭ��Ӧ���ɲ����������п�������������ת��Ϊ���ᣬ���ں����Ľ���������
2ZnO+2SO2����2����ZnS������ȼ�շ���������ԭ��Ӧ���ɲ����������п�������������ת��Ϊ���ᣬ���ں����Ľ���������
���Դ��ǣ������� �ڸú�п���л�����FeS�����ʣ�����������ת��Ϊ�������ӣ��ɼ���п�۳�ȥ�������ӣ����ӷ���ʽ��Zn+Fe2+=Zn2++Fe��
���Դ��ǣ��û���Fe�ȣ��Դﵽ������Ŀ�ģ� �ۡ���ѹ�����������˼�壬��֪��Ӧ���к���H+��O2 �� ���Ի�÷ǽ�������S��д����ѧ����ʽΪ��2ZnS+4H++O2=2Zn2++2S��+2H2O��
���Դ��ǣ�2ZnS+4H++O2=2Zn2++2S��+2H2O�� ��3���ٸ��������Ϣ�����Ǧ������Pb2+ �� ���ᱻ��ԭ��NO���ʷ�Ӧ����ʽΪ3Pb+8HNO3=3Pb��NO3��2+2NO��+4H2O��
���Դ��ǣ�3Pb+8HNO3=3Pb��NO3��2+2NO��+4H2O��
������������������������������Ӧ��������������Ʒ�л������ʣ����Բ���I����������������ʹPb����ʣ�࣬��Ŀ���Ƿ�ֹAg���ܽ������Һ��������ܣ��׳�����PbSO4���棬��������Pb��NO3��2��Һ���ϴ�ӣ���ȥCaSO4 ��
���Դ��ǣ���ֹAg���ܽ������Һ����ʹAg���ڽ������У�����ȥ����������Ǧ�������������ƣ�
��Pb��NO3��2��Һ���������������Ǧ���������ᣬ����ĸҺ��ѭ�������ڲ���I����������Ҫ��HNO3 �� �����϶�п���Ʋ������������п��������
���Դ��ǣ�HNO3��Zn��п�� ��4�������õ��ӷ�����ԭ��Ӧ���缫����ʽΪ��Ag2O+H2O+2e���T2Ag+2OH�� ��
���Դ��ǣ�Ag2O+H2O+2e���T2Ag+2OH�� ��

 ����ȫ���ִʾ��ƪ��ϵ�д�
����ȫ���ִʾ��ƪ��ϵ�д� �����߿����ϵ�д�
�����߿����ϵ�д�