题目内容
9.已知在干冰晶胞中每个顶角各有1个CO2分子,每个面心各有一个CO2分子.实验测得25℃时干冰晶体的晶胞边长为a cm,其摩尔质量为M g/mol,则该干冰晶体的密度为(单位:g/cm3)( )| A. | $\frac{4M}{{a}^{3}}$ | B. | $\frac{M}{{a}^{3}{N}_{A}}$ | C. | $\frac{2M}{{a}^{3}{N}_{A}}$ | D. | $\frac{4M}{{a}^{3}{N}_{A}}$ |
分析 每个顶点上的二氧化碳分子被8个晶胞共用,每个面心上的二氧化碳分子被两个晶胞共用,所以该晶胞中二氧化碳分子个数=$8×\frac{1}{8}+6×\frac{1}{2}$=4,根据ρ=$\frac{m}{V}$=$\frac{\frac{4M}{{N}_{A}}}{V}$计算即可.
解答 解:每个顶点上的二氧化碳分子被8个晶胞共用,每个面心上的二氧化碳分子被两个晶胞共用,所以该晶胞中二氧化碳分子个数=$8×\frac{1}{8}+6×\frac{1}{2}$=4,ρ=$\frac{m}{V}$=$\frac{\frac{4M}{{N}_{A}}}{V}$=$\frac{\frac{4Mg/mol}{N{\;}_{A}}}{(acm)^{3}}$=$\frac{4M}{{a}^{3}{N}_{A}}$g/cm3,
故选:D.
点评 本题考查了晶胞的计算,利用均摊法计算晶胞中含有的二氧化碳分子个数,再根据密度公式计算其密度即可,难度中等.

练习册系列答案
相关题目
20.两种气态烃的混和物共0.3mol,完全燃烧后得11.76L(标况下)CO2和13.5g水,下列说法正确的是( )
| A. | 一定有乙烯 | B. | 可能有甲烷 | ||
| C. | 可能有乙烷 | D. | 一定是甲烷和乙烯的混和物 |
4.实验室需用2mol•L-1硫酸铜溶液450mL,配制时应选用称取硫酸铜的质量是( )
| A. | 144.0 g CuSO4 | B. | 144.0 g CuSO4•5H2O | ||
| C. | 225.0 g CuSO4•5H2O | D. | 250.0 g CuSO4•5H2O |
14.下列化学反应的离子方程式正确的是( )
| A. | Cu溶于稀HNO3:Cu+2H++NO3-═Cu2++NO2↑+H2O | |
| B. | (NH4)2Fe(SO4)2溶液与过量NaOH溶液反应制Fe(OH)2:Fe2++2OH-═Fe(OH)2↓ | |
| C. | 用稀HNO3溶解FeS固体:FeS+2H+═Fe2++H2S↑ | |
| D. | 向NaAlO2溶液中通入过量CO2制Al(OH)3:CO2+AlO2-+2H2O═Al(OH)3↓+HCO3- |
1.常温下,把1ml PH=6的H2SO4溶液加入蒸馏水中,制成100mL溶液,稀释后的溶液中,其C(H+)最接近( )
| A. | 1×10-8mol/L | B. | 1×10-6mol/L | C. | 2×10-8mol/L | D. | 1×10-7mol/L |
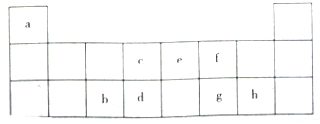 如该表是元素周期表的短周期部分,表中字母分别表示一种元素.请回答下列问题:
如该表是元素周期表的短周期部分,表中字母分别表示一种元素.请回答下列问题: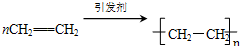 ;
;
 +CH3Br$\stackrel{催化剂}{→}$
+CH3Br$\stackrel{催化剂}{→}$ -CH3+HBr;
-CH3+HBr; .
. $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$ .
. +
+ .
. .
.