题目内容
13.200mL 0.3mol/L Na2SO4溶液和100mL 0.2mol/L Al2(SO4)3的溶液混合后,加水稀释至500mL.稀释后溶液中SO42-的物质的量的浓度为( )| A. | 0.4mol/L | B. | 0.24mol/L | C. | 0.35mol/L | D. | 0.5mol/L |
分析 根据n=cV分别计算出200mL 0.3mol/L Na2SO4溶液和100mL 0.2mol/L Al2(SO4)3溶液中含有溶质的物质的量,再根据化学式组成计算出硫酸根离子的物质的量,从而得出混合液中含有的硫酸根离子的总物质的量,最后根据c=$\frac{n}{V}$计算出稀释后溶液中SO42-的物质的量的浓度.
解答 解:200mL 0.3mol/L Na2SO4溶液中含有硫酸钠的物质的量为:0.3mol/L×0.2L=0.06mol,0.06mol硫酸钠中含有0.06mol硫酸根离子,
100mL 0.2mol/L Al2(SO4)3溶液中含有溶质硫酸铝的物质的量为:0.2mol/L×0.1L=0.02mol,0.02mol硫酸铝中含有0.06mol硫酸根离子,
两溶液混合后,溶液中含有硫酸根离子的总物质的量为:0.06mol+0.06mol=0.12mol,
稀释过程中硫酸根离子的物质的量不变,则稀释后溶液中SO42-的物质的量的浓度为:$\frac{0.12mol}{0.5L}$=0.24mol/L,
故选B.
点评 本题考查了物质的量浓度的计算,题目难度中等,掌握物质的量浓度的概念及表达式即可解答,注意明确溶液稀释过程中溶质的物质的量不变.

练习册系列答案
 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案
相关题目
3.常温下,下列液体pH>7的是( )
| A. | 正常的人体血液 | B. | 食盐溶液 | C. | 橙汁 | D. | 胃液 |
4.室温下0.1mol/L的NH4CN溶液的pH等于9.32.下列说法错误的是( )
| A. | 上述溶液能使甲基橙试剂变黄色 | |
| B. | 室温下,NH3•H2O是比HCN更弱的电解质 | |
| C. | 上述溶液中CN-的水解程度大于NH4+的水解程度 | |
| D. | 室温下,0.1mol/LNaCN溶液中,CN-的水解程度小于上述溶液中CN-的水解程度 |
1. 在有机物分子中,若某个碳原子连接着四个不同的原子或原子团,这种碳原子称为“手性碳原子”.凡有一个手性碳原子的物质,它就一定具有光学活性,某物质如图,具有光学活性,发生下列哪个反应后生成的有机物无光学活性( )
在有机物分子中,若某个碳原子连接着四个不同的原子或原子团,这种碳原子称为“手性碳原子”.凡有一个手性碳原子的物质,它就一定具有光学活性,某物质如图,具有光学活性,发生下列哪个反应后生成的有机物无光学活性( )
 在有机物分子中,若某个碳原子连接着四个不同的原子或原子团,这种碳原子称为“手性碳原子”.凡有一个手性碳原子的物质,它就一定具有光学活性,某物质如图,具有光学活性,发生下列哪个反应后生成的有机物无光学活性( )
在有机物分子中,若某个碳原子连接着四个不同的原子或原子团,这种碳原子称为“手性碳原子”.凡有一个手性碳原子的物质,它就一定具有光学活性,某物质如图,具有光学活性,发生下列哪个反应后生成的有机物无光学活性( )| A. | 与甲酸发生酯化反应 | B. | 与NaOH溶液共热 | ||
| C. | 与银氨溶液作用 | D. | 与浓溴水作用 |
18.下列物质在给定条件下同分异构体数目正确的是( )
| A. | C4H10的同分异构体有3种 | |
| B. | 分子组成是C5H10O2属于羧酸的同分异构体有5种 | |
| C. | 分子组成是C4H10O属于醇类的同分异构体有3种 | |
| D. | 结构为 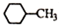 的物质的一溴代物有5种 的物质的一溴代物有5种 |
5.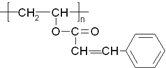 光刻胶是大规模集成电路印刷电路版技术中的关键材料,某一光刻胶的主要成分如图所示,下列有关说法正确的是( )
光刻胶是大规模集成电路印刷电路版技术中的关键材料,某一光刻胶的主要成分如图所示,下列有关说法正确的是( )
 光刻胶是大规模集成电路印刷电路版技术中的关键材料,某一光刻胶的主要成分如图所示,下列有关说法正确的是( )
光刻胶是大规模集成电路印刷电路版技术中的关键材料,某一光刻胶的主要成分如图所示,下列有关说法正确的是( )| A. | 合成此高聚物的单体的化学式为C11H10O2 | |
| B. | 发生加成反应时1 mol该物质可消耗4molH2 | |
| C. | 该物质可稳定存在于碱性溶液中 | |
| D. | 该物质可经过缩聚反应制得 |
2.下列粒子的结构示意图中,表示氯离子的是( )
| A. | 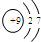 | B. | 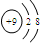 | C. | 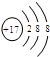 | D. | 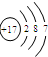 |
16.有关高温结构陶瓷和光导纤维说法不正确的是( )
| A. | 光导纤维是一种能高质量传导光的玻璃纤维 | |
| B. | 光导纤维的抗干扰性能好,不发生电辐射,通讯质量高,能防窃听 | |
| C. | 高温结构陶瓷弥补了金属材料的弱点,但是硬度却远远低于金属材料 | |
| D. | 氮化硅陶瓷是一种重要的结构材料,具有超硬性,它能与氢氟酸反应 |
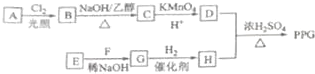
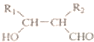
 .
. .
.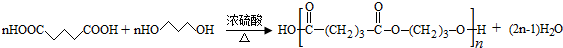 ;
; (写结构简式)
(写结构简式)