题目内容
【题目】某种电池的正极材料,可通过下列方法制得:①称取一定量的固体铁氧体磁性材料溶于过量盐酸,接着先后加入双氧水和氢氧化钠溶液,静置24h,过滤
②将沉淀加入反应瓶中,加入过量的氢氟酸溶液,80℃恒温加热24ha
③蒸发多余氢氟酸和水,得淡红色FeF3凝胶
④在干燥箱中,以100℃预处理6h,最后掺入铁氧体磁性材料混合研磨制得正极材料
(1)加入双氧水的作用是(用离子方程式表示)
(2)步骤②的反应瓶材质可能是(填序号)
A.玻璃
B.陶瓷
C.聚四氟乙烯
(3)加氢氟酸反生反应的化学方程式为
(4)从安全的角度考虑,在实验室里制三氟化铁时应在中进行
(5)三氟化铁与Li在固体电解质铁氧体中发生置换反应,产生的电流可供电脑使用,该电池反应的化学方程式为
(6)取上述铁氧体样品溶于足量盐酸,在通入标准状况下672mL C12 , Fe2+恰好被完全氧化成Fe3+ , 然后把溶液蒸干,灼烧至恒重得9.6g固体,则该铁氧体的化学式为 .
【答案】
(1)H2O2+2Fe2++2H+=2Fe3++2H2O
(2)C
(3)Fe(OH)3+3HF=FeF3+3H2O
(4)通风橱
(5)FeF3+3Li=Fe+3LiF
(6)2FeO?Fe2O3或Fe4O5
【解析】解:(1)固体铁氧体磁性材料溶于过量盐酸,所得溶液中含有亚铁离子,接着加入H2O2 , H2O2与亚铁离子反应生成三价铁离子,其反应的离子方程式为:H2O2+2Fe2++2H+=2Fe3++2H2O,所以答案是:H2O2+2Fe2++2H+=2Fe3++2H2O;(2)步骤②将沉淀加入反应瓶中,加入过量的氢氟酸溶液反应,由于氢氟酸能与玻璃及陶瓷中的二氧化硅反应,所以反应瓶材质应该为聚四氟乙烯,
所以答案是:C;(3)氢氧化钠与三价铁离子反应生成氢氧化铁,再加HF,生成FeF3和水,则加氢氟酸反生反应的化学方程式为Fe(OH)3+3HF=FeF3+3H2O,
所以答案是:Fe(OH)3+3HF=FeF3+3H2O;(4)HF属于有毒的气体,为了防止中毒,则制备三氟化铁时应在通风橱中进行,所以答案是:通风橱;(5)三氟化铁与Li在固体电解质铁氧体中发生置换反应生成Fe和LiF,该电池反应的化学方程式为FeF3+3Li=Fe+3LiF,所以答案是:FeF3+3Li=Fe+3LiF;(6)取上述铁氧体样品溶于足量盐酸,在通入标准状况下672mL C12 , 则氯气的物质的量为0.03mol,
由2Fe2++Cl2=2Fe3++2Cl﹣ , 可知Fe2+为0.06mol,则原铁氧体样品中n(FeO)=0.06mol,
把溶液蒸干,灼烧至恒重得9.6g固体为Fe2O3 , 则n(Fe2O3)= ![]() =0.06mol,则原来溶液中Fe元素共0.06×2=0.12mol,
=0.06mol,则原来溶液中Fe元素共0.06×2=0.12mol,
所以原来溶液中n(Fe3+)=n(Fe)﹣n(Fe2+)=0.12mol﹣0.06mol=0.06mol,则原铁氧体样品中n(Fe2O3)=0.06mol× ![]() =0.03,
=0.03,
所以原铁氧体样品中n(FeO):n(Fe2O3)=0.06mol:0.03mol=2:1,故铁氧体的化学式为2FeOFe2O3或Fe4O5;
所以答案是:2FeOFe2O3或Fe4O5 .

 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案【题目】结合下表回答下列问题:
物质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
溶度积/25 ℃ | 8.0×10-16 | 2.2×10-20 | 4.0×10-38 |
完全沉淀时的pH范围 | ≥9.6 | ≥6.4 | 3~4 |
现有某酸性CuCl2溶液中含有少量的FeCl2,为得到纯净的CuCl2·2H2O晶体,按如图步骤进行提纯:
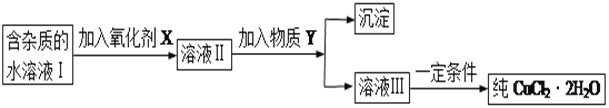
(1)最适合作氧化剂X的是_________(填字母),加入X的目的是____________________________________。
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
加入的物质Y是____________(填化学式),调至溶液pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=____________。过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2·2H2O晶体。
(2)在空气中直接加热CuCl2·2H2O晶体得不到纯的无水CuCl2,由CuCl2·2H2O晶体得到纯的无水CuCl2的合理方法是______________________________________________________。
(3)含Cr2O![]() 的废水毒性较大,某工厂废水中含5.0×10-3 mol·L-1的Cr2O
的废水毒性较大,某工厂废水中含5.0×10-3 mol·L-1的Cr2O![]() ,为了使废水的排放达标,进行如下处理:
,为了使废水的排放达标,进行如下处理:
![]()
①绿矾化学式为FeSO4·7H2O,反应(I)的离子方程式为________________________________;
②若处理后的废水中c(Cr3+)=3.0×10-6 mol·L-1,则废水中c(Fe3+)= _________ mol·L-1。(Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cr(OH) 3]=6.0×10-31)