题目内容
【题目】某研究性学习小组请你参与“研究铁与水反应所得固体物质的成分、性质及再利用”实验探 究,并共同回答下列问题:
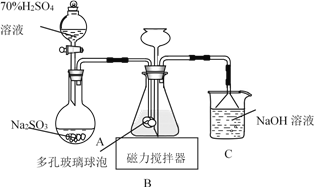
探究一:设计如图所示装置进行“铁与水反应”的实验(夹持仪器略).
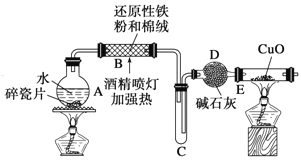
(1)硬质玻璃管 B 中发生反应的化学方程式为:________________________________.。
(2)反应前 A 中投放碎瓷片的目的是___________________.。
(3)装置 E 中的现象是_______________________。
探究二:设计如下实验方案确定反应后硬质玻璃管 B 中黑色固体的成分。
(4)待硬质玻璃管 B 冷却后,取少许其中的固体物质溶于___________________后,将所得溶液分成两份。
(5)一份滴加几滴 KSCN 溶液。若溶液变血红色,推断硬质玻璃管 B 中固体物质的成分为______________________(选 填序号,下同);若溶液未变血红色,推断硬质玻璃管 B 中固体物质的成分为__________________________________。
①一定有 Fe3O4 ②一定有 Fe ③只有 Fe3O4 ④只有 Fe
(6)另一份用_____(填仪器名称)加入_____(填试剂和现象),可以 证明溶液中存在 Fe2+。
探究三:设计如下流程测定反应后硬质玻璃管 B 中固体含铁元素的质量分数。
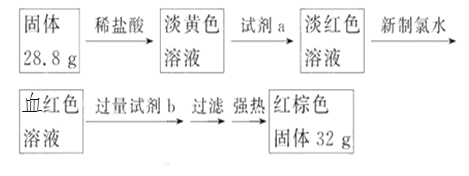
(7)试剂 b 的化学式是_____。
(8)计算反应后 B 装置中铁元素的质量分数为_____。
【答案】(1)![]()
![]()
![]()
(2)防止暴沸
(3)黑色固体变红,右端管壁有水珠
(4)稀硫酸 (5)① ②
(6)胶头滴管 酸性KMnO4溶液,溶液褪色
(7)NaOH (8)77.8%
【解析】
【探究一】(1)Fe与水反应的化学方程式为:
3Fe+4H2O(g)![]() Fe3O4+4H2。
Fe3O4+4H2。
(2)碎瓷片的作用是防止暴沸。
(3)装置E中发生反应:H2+CuO![]() Cu+H2O,现象是:黑色固体变红,右端管壁有水珠。
Cu+H2O,现象是:黑色固体变红,右端管壁有水珠。
【探究二】在验证反应后黑色固体的成分时,检验Fe3+,最佳试剂为KSCN溶液;在确定存在Fe3+时,检验Fe2+,可用酸性KMnO4溶液。由于酸性KMnO4溶液与盐酸发生反应,所以在溶解反应后的黑色固体时,不能用盐酸,也不能用硝酸(因为HNO3可氧化Fe2+),可用稀硫酸。
【探究三】由“红棕色固体”知,该物质为Fe2O3,则![]() 和NaCl及过量
和NaCl及过量![]() ,所以试剂b为NaOH溶液。m(Fe2O3)="32" g,则n(Fe2O3)="0.2" mol,则n(Fe)="0.4" mol,则反应后B装置中铁元素的质量分数为:
,所以试剂b为NaOH溶液。m(Fe2O3)="32" g,则n(Fe2O3)="0.2" mol,则n(Fe)="0.4" mol,则反应后B装置中铁元素的质量分数为:![]() ×100%≈77.8%。
×100%≈77.8%。

【题目】用下图装置进行①中实验,对应②中现象正确,且能达成相应实验目的的是( )
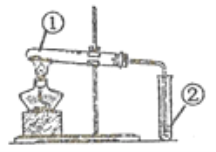
选项 | ①中实验 | ②中现象 | 实验目的 |
A | 将浸透石蜡油的石棉加热 | Br2的CCl4溶液褪色 | 石蜡裂解产物中含有烯烃 |
B | 加热NH4Cl固体 | 酚酞溶液变红 | 制备氨气并检验氨气性质 |
C | 加热NaHCO3与Na2CO3混合粉末 | 澄清石灰水变浑浊 | 验证NaHCO3具有热不稳定性 |
D | 加热铁粉及湿棉花 | 肥皂水中有气泡冒出 | Fe与H2O发生了置换反应 |
A. A B. B C. C D. D