题目内容
17.镁条和铝片为电极,并用导线连接同时插入NaOH溶液中,下列说法正确的是( )| A. | 镁条作负极,电极反应:Mg-2e-=Mg2+ | |
| B. | 铝片作负极,电极反应:Al+4OH--3e--=[Al(OH)4]- | |
| C. | 电流从Al电极沿导线流向Mg电极 | |
| D. | 铝片上有气泡产生 |
分析 A、原电池中失电子的一极是负极,发生氧化反应;
B、Al在负极发生失电子的氧化反应,生成[Al(OH)4]-;
C、在原电池中,电子从负极流向正极,电流从正极流向负极;
D、Mg作正极,正极上水得电子生成氢气,Al在负极发生失电子的氧化反应,生成[Al(OH)4]-.
解答 解:A、金属镁和氢氧化钠溶液不能发生氧化还原反应,金属铝能反应,在原电池中,失电子的一极是负极,所以金属铝是负极,Al发生失电子的氧化反应,即Al+4OH-→[Al(OH)4]-+3e-,故A错误;
B、金属铝是负极,负极发生失电子的氧化反应,即Al+4OH-→[Al(OH)4]-+3e-,故B正确;
C、Mg条和Al片为电极,用导线连接同时插入NaOH溶液中,此时铝片是负极,镁条是正极,在原电池中,电子从负极流向正极,即电子从Al电极沿导线流向Mg电极,电流从Mg电极沿导线流向Al电极,故C错误;
D、Mg作正极,正极上水得电子生成氢气,则Mg片有气泡生成,故D错误.
故选B.
点评 本题考查学生原电池的工作原理知识,注意原电池中,失电子的极是负极,不一定是活泼的金属就做负极,难度不大.

练习册系列答案
相关题目
7.乙烯产量是衡量一个国家石油化工发展水平的标志.下列关于乙烯说法正确的是( )
| A. | 与乙烷互为同分异构体 | B. | 分子中存在C≡C | ||
| C. | 能使酸性高锰酸钾溶液褪色 | D. | 分子中存在C=O |
8.有机分子中,当某个碳原子连接着四个不同的原子或原子团时,这种碳原子称为“手性碳原子”.例如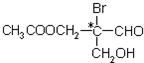 是某有机物分子的结构简式,其中带“*”的碳原子就是手性碳原子.当此有机物分别发生下列反应后,生成的有机物分子中仍含有手性碳原子的是( )
是某有机物分子的结构简式,其中带“*”的碳原子就是手性碳原子.当此有机物分别发生下列反应后,生成的有机物分子中仍含有手性碳原子的是( )
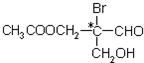 是某有机物分子的结构简式,其中带“*”的碳原子就是手性碳原子.当此有机物分别发生下列反应后,生成的有机物分子中仍含有手性碳原子的是( )
是某有机物分子的结构简式,其中带“*”的碳原子就是手性碳原子.当此有机物分别发生下列反应后,生成的有机物分子中仍含有手性碳原子的是( )| A. | 与乙酸发生酯化反应 | B. | 与NaOH水溶液反应 | ||
| C. | 催化剂作用下与H2反应 | D. | 与银氨溶液作用发生银镜反应 |
5. 我国在反兴奋剂问题上的坚决立场是支持“人文奥运”的重要体现.某种兴奋剂的结构如图,关于它的说法正确的是( )
我国在反兴奋剂问题上的坚决立场是支持“人文奥运”的重要体现.某种兴奋剂的结构如图,关于它的说法正确的是( )
 我国在反兴奋剂问题上的坚决立场是支持“人文奥运”的重要体现.某种兴奋剂的结构如图,关于它的说法正确的是( )
我国在反兴奋剂问题上的坚决立场是支持“人文奥运”的重要体现.某种兴奋剂的结构如图,关于它的说法正确的是( )| A. | 它的化学式为C20H25O3 | |
| B. | 该化合物只能发生取代反应 | |
| C. | 从结构上看,它属于醇类 | |
| D. | 从元素组成上看,它可以在氧气中燃烧生成CO2和水 |
12. 将一块镁铝的合金投入1mo1•L-1的一定体积的稀盐酸中,待合金完全溶解后,往溶液里滴入1mo1•L-1的NaOH溶液,生成沉淀物质的量与加入NaOH溶液体积(单位mL)的关系如图.下列说法中不正确的是( )
将一块镁铝的合金投入1mo1•L-1的一定体积的稀盐酸中,待合金完全溶解后,往溶液里滴入1mo1•L-1的NaOH溶液,生成沉淀物质的量与加入NaOH溶液体积(单位mL)的关系如图.下列说法中不正确的是( )
 将一块镁铝的合金投入1mo1•L-1的一定体积的稀盐酸中,待合金完全溶解后,往溶液里滴入1mo1•L-1的NaOH溶液,生成沉淀物质的量与加入NaOH溶液体积(单位mL)的关系如图.下列说法中不正确的是( )
将一块镁铝的合金投入1mo1•L-1的一定体积的稀盐酸中,待合金完全溶解后,往溶液里滴入1mo1•L-1的NaOH溶液,生成沉淀物质的量与加入NaOH溶液体积(单位mL)的关系如图.下列说法中不正确的是( )| A. | 由图可以确定该镁铝合金中铝的质量为0.27g | |
| B. | 当滴入1mo1•L-1的NaOH溶液85mL时,所得沉淀为Mg(OH)2和Al(OH)3 | |
| C. | 由图可以确定a的取值范围为:0≤a≤50 | |
| D. | 由图可以确定该合金中镁铝物质的量之比0<$\frac{n(Mg)}{n(AI)}$<2.5 |



