题目内容
【题目】取等物质的量浓度的NaOH溶液两份A和B,每份10mL,分别向A、B中通入不等量的CO2 , 再继续向两溶液中逐滴加入0.1 mol/L的盐酸,标准状况下产生的CO2的体积与所加盐酸体积之间的关系如图所示,试回答下列问题: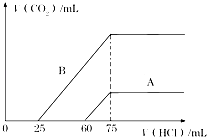
(1)原NaOH溶液的物质的量浓度为 .
(2)曲线A表明,原NaOH溶液中通入CO2后,所得溶液中的溶质成分是 , 其物质的量之比为 .
(3)曲线B表明,原NaOH溶液中通入CO2后,所得溶液加盐酸后产生CO2气体体积(标准状况)的最大值为mL.
【答案】
(1)0.75mol/L
(2)NaOH、Na2CO3;3:1
(3)112
【解析】解:(1)加入75ml盐酸时二氧化碳的体积达最大,此时溶液为氯化钠溶液.根据氯离子、钠离子守恒,所以n(NaOH)=n(NaCl)=n(HCl)=0.075L×0.1mol/L=0.0075mol,所以c(NaOH)= ![]() =0.75mol/L,所以答案是:0.75mol/L;(2)CO2与NaOH反应为①CO2+NaOH=NaHCO3 , ②CO2+2NaOH=Na2CO3+H20, 当n(CO2):n(NaOH)≥1,反应按①进行,等于1时,CO2、NaOH恰好反应生成NaHCO3;大于1时,生成生成NaHCO3 , CO2有剩余;当
=0.75mol/L,所以答案是:0.75mol/L;(2)CO2与NaOH反应为①CO2+NaOH=NaHCO3 , ②CO2+2NaOH=Na2CO3+H20, 当n(CO2):n(NaOH)≥1,反应按①进行,等于1时,CO2、NaOH恰好反应生成NaHCO3;大于1时,生成生成NaHCO3 , CO2有剩余;当 ![]() <n(CO2):n(NaOH)<1,反应按①②进行,CO2、NaOH反应,无剩余,生成物为NaHCO3、Na2CO3;当n(CO2):n(NaOH)≤
<n(CO2):n(NaOH)<1,反应按①②进行,CO2、NaOH反应,无剩余,生成物为NaHCO3、Na2CO3;当n(CO2):n(NaOH)≤ ![]() ,反应按②进行,等于
,反应按②进行,等于 ![]() ,时,CO2、NaOH恰好反应生成Na2CO3;小于
,时,CO2、NaOH恰好反应生成Na2CO3;小于 ![]() 时,生成Na2CO3 , NaOH有剩余;由曲线A可知从60ml到75ml为碳酸氢钠与盐酸反应,反应方程式为NaHCO3+HCl=NaCl+CO2↑+H2O,所以n(NaHCO3)=n(HCl)=(0.075﹣0.06)L×0.1mol/L=1.5×10﹣3mol,根据C原子守恒,所以n(CO2)=n(NaHCO3)=1.5×10﹣3mol,
时,生成Na2CO3 , NaOH有剩余;由曲线A可知从60ml到75ml为碳酸氢钠与盐酸反应,反应方程式为NaHCO3+HCl=NaCl+CO2↑+H2O,所以n(NaHCO3)=n(HCl)=(0.075﹣0.06)L×0.1mol/L=1.5×10﹣3mol,根据C原子守恒,所以n(CO2)=n(NaHCO3)=1.5×10﹣3mol,
由(1)可知,n(NaOH)=0.0075mol,所以n(CO2):n(NaOH)=1.5×10﹣3mol:0.0075mol=1:5,小于1:2,所以反应按②进行,NaOH有剩余,溶液中溶质为Na2CO3和NaOH.根据C原子守恒,所以n(Na2CO3)=n(CO2)=1.5×10﹣3mol,再根据钠离子守恒,得溶液中氢氧化钠的物质的量为0.0075mol﹣1.5×10﹣3mol×2=0.0045mol,所以溶液中NaOH与Na2CO3的物质的量之比为0.0045mol:1.5×10﹣3mol=3:1.所以答案是:NaOH、Na2CO3;3:1; (3)由曲线B可知从25ml到75ml为碳酸氢钠与盐酸反应生成二氧化碳,反应方程式为NaHCO3+HCl=NaCl+CO2↑+H2O,所以n(CO2)=n(HCl)=(0.075ml﹣0.025ml)×0.1mol/L=0.005mol,所以CO2气体体积为0.005mol×22.4L/mol=0.112L=112mL,所以答案是:112.

 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案【题目】如表所示的是关于有机物A、B的信息:
A | B |
①能使溴的四氯化碳溶液褪色 | ①由C、H两种元素组成 |
根据表中信息回答下列问题:
(1)A与溴的四氯化碳溶液反应的产物的名称为 .
(2)B具有的性质是(填序号).
①无色无味液体②有毒③不溶于水④密度比水大⑤能使酸性KMnO4溶液和溴水褪色⑥任何条件下均不与氢气反应⑦与溴水混合后液体分层且上层呈橙红色
(3)A的同系物用通式CnHm表示,B的同系物用通式CxHy表示,当CnHm、CxHy分别出现同分异构体时,碳原子数的最小值n= , x= .