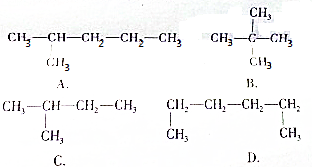题目内容
5.在无色透明的酸性溶液中,能大量共存的离子组是( )| A. | Al3+、NH4+、Cl-、HCO3- | B. | Na+、NO3-、SO42-、I- | ||
| C. | Na+、Mg2+、Cl-、SO42- | D. | Fe3+、K+、Cl-、NO3- |
分析 酸性溶液中含有大量的H+,利用离子之间不能结合生成水、气体、沉淀来分析离子的共存,并注意离子在水溶液中颜色.
解答 解:A.因H+、HCO3-能结合生成二氧化碳和水,则不能大量共存,故A错误;
B.酸性条件下,NO3-、I-发生氧化还原反应而不能大量共存,故B错误;
C.离子之间不发生任何反应,且溶液无色,可大量共存,故C正确;
D.Fe3+有颜色,不符合题目无色要求,故D错误.
故选C.
点评 本题考查离子的共存问题,为高频考点,学生熟悉离子之间的反应、复分解反应的条件及常见离子在水中的颜色即可解答.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
16.已知:W是组成信息高速公路骨架的元素之一,且X、Y、Z、W在元素周期表中的位置如图所示.下列说法正确的是( )
| X | Y | |
| Z | W |
| A. | 最高正化合价:Z>X=W>Y | |
| B. | 原子半径:Y>X>W>Z | |
| C. | 最高价氧化物对应水化物的酸性:Z<X<W<Y | |
| D. | 最高价含氧酸的钠盐溶液能与SO2反应的:X、Y、Z、W |
16.下列说法不正确的是( )
| A. | 含氟氯代烃的废弃发泡塑料对臭氧层无影响 | |
| B. | 煤的气化是高效且清洁地利用煤炭的重要途径 | |
| C. | 将聚乙烯塑料经热裂解可得重新利用的小分子 | |
| D. | 使用无磷洗衣粉可缓解水体富营养化的趋势 |
13.能通过化学反应使溴水褪色,又能使高锰酸钾酸性溶液褪色的是( )
| A. | 乙烷 | B. | 乙醇 | C. | 乙酸 | D. | 二氧化硫 |
20.下列叙述正确的是(NA表示阿伏加德罗常数)( )
| A. | 0.1 mol•L-1NH4A溶液显中性,说明HA为弱电解质 | |
| B. | 1 mol FeI2与足量氯气反应时转移的电子数为2NA | |
| C. | Na、Al、Fe三种单质在一定条件下都能与水反应生成H2和相应的碱 | |
| D. | 水电离出的c(OH-)=1×10-13mol•L-1的溶液中,可能大量存在:Na+、K+、Cl-、HCO3- |
10.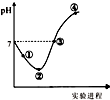 常温下,将Cl2缓慢通入一定量的水中至饱和,然后向所得饱和氯水中逐滴加入0.1mol•L-1的氢氧化钠溶液,整个过程中pH变化如图所示,下列有关叙述正确的是( )
常温下,将Cl2缓慢通入一定量的水中至饱和,然后向所得饱和氯水中逐滴加入0.1mol•L-1的氢氧化钠溶液,整个过程中pH变化如图所示,下列有关叙述正确的是( )
 常温下,将Cl2缓慢通入一定量的水中至饱和,然后向所得饱和氯水中逐滴加入0.1mol•L-1的氢氧化钠溶液,整个过程中pH变化如图所示,下列有关叙述正确的是( )
常温下,将Cl2缓慢通入一定量的水中至饱和,然后向所得饱和氯水中逐滴加入0.1mol•L-1的氢氧化钠溶液,整个过程中pH变化如图所示,下列有关叙述正确的是( )| A. | 曲线起点处水的电离程度最大,可用pH试纸测定溶液pH | |
| B. | ②点之前所发生反应的离子方程式为Cl2+H2O=2H++Cl-+ClO- | |
| C. | 氯气~氯水体系中:c(H+)=c(Cl2)+c(HClO)+c(ClO-) | |
| D. | ③点所示溶液中:c(Na+)=c(Cl-)+c(ClO-) |
17.下列实验方案不能达到实验目的是( )
| 实验目的 | 实验方案 | |
| A | 检验亚硫酸钠固体是否变质 | 取少量固体于试管中,加水溶解,滴加硝酸钡溶液产生白色沉淀,滴加盐酸,观察沉淀是否溶解 |
| B | 测定镁铝混合物中铝的质量分数 | 取mg混合物,加入足量NaOH溶液,充分反应后,过滤、洗涤、烘干,剩余土体ag,计算 |
| C | 检验某无色溶液中说法存在NH4+ | 取少量无色溶液于试管中,滴加NaOH溶液、加热.用湿润的红色石蕊试纸检验生成的气体,观察试纸是否变蓝 |
| D | 除去MgCl2溶液中的少量FeCl3 | 像溶液中加入足量Mg(OH)2分末,充分搅拌、静置、过滤 |
| A. | A | B. | B | C. | C | D. | D |
12.m g下列有机物完全燃烧后,产生的气体通过足量的Na2O2固体,固体增重m g的是( )
| A. | 乙醇 | B. | 乙酸 | C. | 甲醇 | D. | 乙醛 |
 .
.