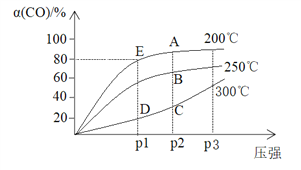
题目内容
【题目】绿矾被广泛用于医药和工业领域,工业上两种制备绿矾(FeSO4·7H20)的流程如图所示,根据题意回答下列问题:
方法一:利用黄铜矿粉(主要成分为CuFeS2)制取绿矾

(1)试剂a和试剂b的化学式分别是__________________________, 操作1的名称是_____________。
(2)有一种细菌在有氧气存在的稀硫酸中,可以将CuFeS2氧化成硫酸盐,写出该反应的化学方程式:____________________________________________________。
方法二:利用工业废铁屑制取绿矾

(3)操作Ⅰ需要用到的玻璃仪器名称是__________________________。
(4)通过检验CO32-来判断操作Ⅰ是否洗涤干净,检验的方法是__________________________。
【答案】稀H2SO4 Fe 过滤 4CuFeS2+17O2+2H2SO4=4CCuSO4+2Fe2(SO4)3+2H2O 烧杯、玻璃棒、漏斗 取少量最后一次洗涤液于试管中, 滴加BaCl2溶液,若无白色沉淀生成,则已经洗涤干净;若有白色沉淀生成,则未洗涤
【解析】
黄铜矿粉(主要成分为CuFeS2)、废铁屑都能制取绿矾,依据工艺流程图分析发生的反应,根据物质的性质选择分离方法和仪器等。
(1)用稀硫酸浸取黄铜矿粉并通入氧气,CuFeS2被氧化为CuSO4、Fe2(SO4)3留在滤液中;调节pH时溶液1中Fe3+生成沉淀,滤渣2为Fe(OH)3;滤液2能制得绿矾必为FeSO4溶液,故试剂a为稀硫酸、试剂b为铁粉、操作1为过滤。
(2)据题意,反应物有CuFeS2、O2、H2SO4,生成物有CuSO4、Fe2(SO4)3,该反应的化学方程式4CuFeS2+17O2+2H2SO4=4CCuSO4+2Fe2(SO4)3+2H2O。
(3)操作Ⅰ为过滤、洗涤,需要的玻璃仪器名称有烧杯、玻璃棒、漏斗。
(4)洗涤铁屑是为了除去表面吸附的可溶性杂质。检验CO32-来判断操作Ⅰ是否洗涤干净的方法:取少量最后一次洗涤滤出的液体于试管中, 滴加BaCl2溶液,若无白色沉淀生成,则已经洗涤干净,否则未洗涤。

【题目】砷化镓是继硅之后研究最深入、应用最广泛的半导体材料。回答下列问题:
(1)Ga 基态原子核外电子排布式为 ____,As 基态原子核外有_________个未成对电子。
(2)Ga、As、Se 的第一电离能中大到小的顺序是 __________,Ga、As、Se 的电负性由大到小的顺序是 ____。
(3)比较下列镓的卤化物的熔点和沸点,分析其变化规律及原因:_____。
镓的卤化物 | GaCl3 | GaBr3 | GaI3 |
熔点/℃ | 77.75 | 122.3 | 211.5 |
沸点/℃ | 201.2 | 279 | 346 |
GaF3 的熔点超过 1000 ℃,可能的原因是 _____________。
(4)二水合草酸镓的结构如图 1 所示,其中镓原子的配位数为_____,草酸根中碳原子的杂化轨道类型为 ____。
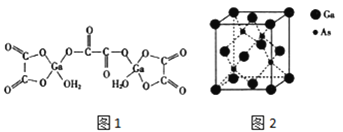
(5)砷化镓的立方晶胞结构如图 2 所示,晶胞参数为 a=0.565nm,砷化镓晶体的密度为_____g/ cm3(设 NA为阿伏加德罗常数的值,列出计算式即可)。
【题目】实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是

选项 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
A | 浓氨水 | CaO | NH3 | H2O |
B | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 |
C | 稀硝酸 | Cu | NO2 | H2O |
D | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |