题目内容
【题目】乙炔(C2H2)是制造草酸、乙醛、醋酸等有机化合物的基本原料。
(1)某小组同学以电石(主要成分为CaC2,含少量CaS及Ca3P2等杂质)为原料,利用下图所示实验装置(夹持装置略去,下同)制备C2H2。
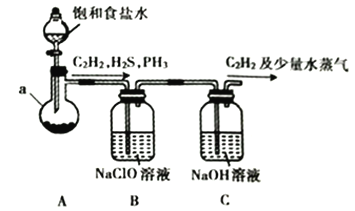
①仪器a的名称为__________________________。
②CaC2的电子式为________________________________。
③装置B中的NaClO溶液能将H2S、PH3氧化为硫酸、磷酸,本身被还原为NaCl。其中PH3被氧化的离子方程式为________________________________。
(2)该小组同学通过查阅文献资料得知:用Hg(NO3)2作催化剂时,浓硝酸能将乙炔气体氧化为草酸(H2C2O4),实验装置如下图所示。
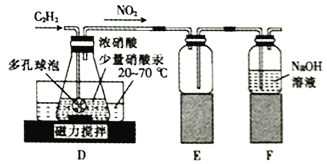
①装置E的作用是_________________________________________。
②装置D中生成H2C2O4的化学方程式为_________________________________。
③装置D中锥形瓶内的液体经过___________(填操作名称)、洗涤、干燥等步骤得到H2C2O4·2H2O晶体。
(3)该小组同学测定了晶体中H2C2O4·2H2O的质量分数,实验步骤如下:
i.准确称取mg晶体,加入适量的蒸馏水溶解,再加入少量稀硫酸;
ii.将i所得溶液用c mol/LKMnO4标准溶液进行滴定,滴定时KMnO4被还原为Mn2+,滴定至终点时消耗标准溶液VmL。
①滴定过程中发现褪色速率先慢后明显加快,除反应放热外,还可能的原因是____________。
②晶体中H2C2O4·2H2O的质量分数为_________(用含m、c、V的式子表示)。
【答案】 蒸馏烧瓶 ![]() PH3+4C1O-==H3PO4+4C1- 安全瓶,防发生倒吸 C2H2+8HNO3(浓)
PH3+4C1O-==H3PO4+4C1- 安全瓶,防发生倒吸 C2H2+8HNO3(浓) ![]() H2C2O4+8NO2↑+4H2O 加热蒸发、冷却结晶、过滤 反应生成的Mn2+是该反应的催化剂 (63cV/2m)% (写成(31.5cV/m)%也可)
H2C2O4+8NO2↑+4H2O 加热蒸发、冷却结晶、过滤 反应生成的Mn2+是该反应的催化剂 (63cV/2m)% (写成(31.5cV/m)%也可)
【解析】(1)①仪器a的名称为蒸馏烧瓶;②CaC2的电子式为![]() ;③装置B中的NaClO溶液能将H2S、PH3氧化为硫酸、磷酸,本身被还原为NaCl。其中PH3被氧化的离子方程式为PH3+4C1O-==H3PO4+4C1-;(2)①装置E的作用是安全瓶,防发生倒吸;②装置D中乙炔与浓硝酸反应生成H2C2O4、二氧化氮和水,反应的化学方程式为C2H2+8HNO3(浓)
;③装置B中的NaClO溶液能将H2S、PH3氧化为硫酸、磷酸,本身被还原为NaCl。其中PH3被氧化的离子方程式为PH3+4C1O-==H3PO4+4C1-;(2)①装置E的作用是安全瓶,防发生倒吸;②装置D中乙炔与浓硝酸反应生成H2C2O4、二氧化氮和水,反应的化学方程式为C2H2+8HNO3(浓) ![]() H2C2O4+8NO2↑+4H2O;③装置D中锥形瓶内的液体经过加热蒸发、冷却结晶、过滤、洗涤、干燥等步骤得到H2C2O4·2H2O晶体;(3)①滴定过程中发现褪色速率先慢后明显加快,除反应放热外,还可能的原因是反应生成的Mn2+是该反应的催化剂;②根据反应2MnO4-+5 H2C2O4+6H+=2 Mn2++10CO2↑+8H2O,可知,晶体中H2C2O4·2H2O的质量分数为
H2C2O4+8NO2↑+4H2O;③装置D中锥形瓶内的液体经过加热蒸发、冷却结晶、过滤、洗涤、干燥等步骤得到H2C2O4·2H2O晶体;(3)①滴定过程中发现褪色速率先慢后明显加快,除反应放热外,还可能的原因是反应生成的Mn2+是该反应的催化剂;②根据反应2MnO4-+5 H2C2O4+6H+=2 Mn2++10CO2↑+8H2O,可知,晶体中H2C2O4·2H2O的质量分数为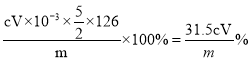 。
。