��Ŀ����
����Ŀ����1molCO��2molH2�����ܱ������У�������Ӧ��CO(g)+2H2(g)![]() CH3OH(g) ��H��������������ͬʱ�����COƽ��ת����[��(CO)]���¶Ⱥ�ѹǿ�Ĺ�ϵ����ͼ��
CH3OH(g) ��H��������������ͬʱ�����COƽ��ת����[��(CO)]���¶Ⱥ�ѹǿ�Ĺ�ϵ����ͼ��
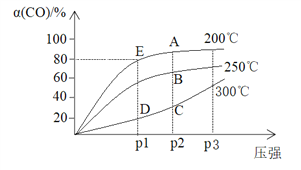
����˵������ȷ����
A. ��H <0
B. C��D����ķ�Ӧ���ʣ�v��C��> v��D��
C. ��E����������Ϊ10L�����¶��µ�ƽ�ⳣ��Ϊk=25
D. ��ҵ������ʵ�ʿ��Ƶ�����200�桢P2ѹǿ��������P3�������ǣ�����ѹǿת���ʱ仯�����ҹ�ҵ�ɱ����ߣ��ò���ʧ
���𰸡�C
����������ͼʾ��֪���¶���200���250�棬COƽ��ת���ʼ�С��ƽ�����ƣ��÷�Ӧ����ӦΪ���ȷ�Ӧ����H <0��A��ȷ��C��D�����Ӧ���¶���ͬ��ѹǿ��ķ�Ӧ���ʿ죬���v��C��>v��D����B��ȷ������CO(g)+2H2(g)![]() CH3OH(g)��Ӧ��E��ʱCOƽ��ת����80%���������ɼ״�����Ϊ1��80%=0.8mol��ʣ��CO����Ϊ1-1��80%=0.2mol��H2����Ϊ2-1��80%��2=0.4mol��������Ũ��Ϊc(CH3OH)=0.08mol/L, c(CO)=0.02 mol/L, c(H2)=0.04 mol/L, ���¶��µ�ƽ�ⳣ��Ϊk=c(CH3OH)/c(CO)��c2(H2)=0.08/0.02��(0.04)2=2500, C��������ͼ����Ե�֪����ҵ������ʵ�ʿ��Ƶ�����200�桢P2ѹǿ��������P3�������ǣ�����ѹǿת���ʱ仯�����ҹ�ҵ�ɱ����ߣ��ò���ʧ��D��ȷ����ȷѡ��C��
CH3OH(g)��Ӧ��E��ʱCOƽ��ת����80%���������ɼ״�����Ϊ1��80%=0.8mol��ʣ��CO����Ϊ1-1��80%=0.2mol��H2����Ϊ2-1��80%��2=0.4mol��������Ũ��Ϊc(CH3OH)=0.08mol/L, c(CO)=0.02 mol/L, c(H2)=0.04 mol/L, ���¶��µ�ƽ�ⳣ��Ϊk=c(CH3OH)/c(CO)��c2(H2)=0.08/0.02��(0.04)2=2500, C��������ͼ����Ե�֪����ҵ������ʵ�ʿ��Ƶ�����200�桢P2ѹǿ��������P3�������ǣ�����ѹǿת���ʱ仯�����ҹ�ҵ�ɱ����ߣ��ò���ʧ��D��ȷ����ȷѡ��C��

����Ŀ����ͼ����ʾ��һЩ���ʻ�����Ĵ�����ϵ����ȷ����

X | Y | Z | |
A | �û���Ӧ | ������ԭ��Ӧ | ���ӷ�Ӧ |
B | ��ˮ����� | ����� | ������ |
C | ������Һ | ���� | ��ɢϵ |
D | �ɱ� | ������ | ������ |
A. AB. BC. CD. D





