题目内容
【题目】砷化镓是继硅之后研究最深入、应用最广泛的半导体材料。回答下列问题:
(1)Ga 基态原子核外电子排布式为 ____,As 基态原子核外有_________个未成对电子。
(2)Ga、As、Se 的第一电离能中大到小的顺序是 __________,Ga、As、Se 的电负性由大到小的顺序是 ____。
(3)比较下列镓的卤化物的熔点和沸点,分析其变化规律及原因:_____。
镓的卤化物 | GaCl3 | GaBr3 | GaI3 |
熔点/℃ | 77.75 | 122.3 | 211.5 |
沸点/℃ | 201.2 | 279 | 346 |
GaF3 的熔点超过 1000 ℃,可能的原因是 _____________。
(4)二水合草酸镓的结构如图 1 所示,其中镓原子的配位数为_____,草酸根中碳原子的杂化轨道类型为 ____。
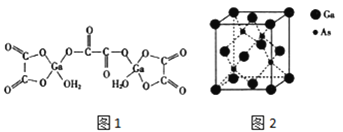
(5)砷化镓的立方晶胞结构如图 2 所示,晶胞参数为 a=0.565nm,砷化镓晶体的密度为_____g/ cm3(设 NA为阿伏加德罗常数的值,列出计算式即可)。
【答案】[Ar]3d104s24p1(或1s22s22p63s23p63d104s24p1)3As>Se>GaSe>As>GaGaCl3、GaBr3、GaI3均为分子晶体,相对分子质量依次增大,分子间作用力增强GaF3 是离子晶体4sp2![]()
【解析】
(1)Ga是31号元素,处于第四周期IIIA族,核外电子排布式为1s22s22p63s23p63d104s24p1,As基态原子核外电子排布式为1s22s22p63s23p63d104s24p3,4p轨道3个电子是未成对电子。故答案为:1s22s22p63s23p63d104s24p1;3;
(2)同周期主族元素随原子序数增大第一电离能呈增大趋势,As原子4p轨道为半充满稳定状态,第一电离能共用同周期相邻元素的,故第一电离能:As>Se>Ga,同周期主族元素自左而右电负性增大,故电负性:Se>As>Ga,故答案为:As>Se>Ga;Se>As>Ga;
(3)GaCl3、GaBr3、GaI3均为分子晶体,相对分子质量依次增大,分子间作用力增强,GaCl3、GaBr3、GaI3的熔沸点依次升高;F元素的电负性很强,GaF3的熔点超过1000℃,可能的原因是GaF3是离子晶体,故答案为:GaCl3、GaBr3、GaI3均为分子晶体,相对分子质量依次增大,分子间作用力增强;GaF3是离子晶体;
(4)Ga原子与周围4个O原子形成4个共价键,镓原子的配位数为4,草酸根中碳原子形成3个σ键,没有孤电子对,杂化轨道数目为3,草酸根中碳原子的杂化轨道类型为sp2,故答案为:4;sp2;
(5)晶胞中Ga原子数目=8×![]() +6×
+6×![]() =4、As原子数目=4,晶胞质量=4×
=4、As原子数目=4,晶胞质量=4×![]() g,晶体密度4×
g,晶体密度4×![]() g÷(0.565×10-7 cm)3=
g÷(0.565×10-7 cm)3=![]() g/cm3,故答案为:
g/cm3,故答案为:![]() 。
。