题目内容
【题目】现有常温条件下甲、乙、丙三种溶液,甲为0.1 mol·L-1的NaOH溶液,乙为0.1 mol·L-1的盐酸,丙为未知浓度的FeCl2溶液,试回答下列问题:
(1)甲溶液的pH=________。
(2)甲、乙、丙三种溶液中由水电离出的c(OH-)的大小关系为________。
(3)某化学兴趣小组认为在隔绝空气的环境中,用酸性KMnO4溶液能测定丙溶液的浓度(已知:5Fe2++MnO+8H+===5Fe3++Mn2++4H2O)。
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250 mL,配制时需要的仪器除天平、药匙、玻璃棒、烧杯、量筒外,还需________(填写仪器名称)。
②滴定实验要用到酸式滴定管或碱式滴定管,使用该仪器的第一步操作是_______。
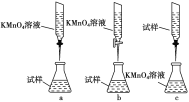
③某同学设计的下列滴定方式中,最合理的是________(夹持部分略去,填字母序号),达到滴定终点的现象是__________________________。
【答案】13丙>甲=乙250 mL容量瓶、胶头滴管检验滴定管是否漏水b滴入最后一滴KMnO4溶液时,溶液由浅绿色变成浅紫色,且半分钟内不褪色
【解析】
(1)0.1molL-1的NaOH溶液中c(OH-)=0.1mol/L,根据Kw=c(H+)c(OH-)计算溶液中c(H+),再根据pH=-logc(H+)计算溶液的pH值;
(2)酸或碱抑制水电离,含有弱根离子的盐促进水电离;
(3) ①精确配制一定物质的量浓度的KMnO4溶液250 mL,配制时需要的仪器有天平、药匙、玻璃棒、烧杯、胶头滴管、250 mL容量瓶;
②使用滴定管的第一步操作是检查是否漏水;
③KMnO4溶液具有强氧化性、氯化亚铁溶液呈酸性,都应该用酸式滴定管盛装;达到滴定终点时,溶液的颜色出现突变,且变色后半分钟不褪色。
(1)甲为0.1mol·L-1的NaOH溶液,则c(OH-)=10-1mol·L-1,c(H+)=![]() =
=![]() mol/L=1×10-13mol·L-1,pH=13。
mol/L=1×10-13mol·L-1,pH=13。
(2)等浓度的c(H+)和c(OH-)对水的电离的抑制程度相同,而盐类的水解能促进水的电离平衡,故三种溶液中由水电离出的c(OH-)的大小关系为:丙>甲=乙;
(3) ①精确配制一定物质的量浓度的KMnO4溶液250 mL,配制时需要的仪器有天平、药匙、玻璃棒、烧杯、胶头滴管、250 mL容量瓶,缺少250 mL容量瓶、胶头滴管,
因此,本题正确答案是:250 mL容量瓶、胶头滴管;
②使用滴定管的第一步操作是检查是否漏水,
因此,本题正确答案是:检验滴定管是否漏水;
③KMnO4溶液具有强氧化性、氯化亚铁溶液呈酸性,都应该用酸式滴定管盛装,a、c均错误,b正确;由方程式可知滴定终点的现象是滴入最后一滴KMnO4溶液时,溶液由浅绿色变成浅紫色,且半分钟内不褪色。
因此,本题正确答案是:b;滴入最后一滴KMnO4溶液时,溶液由浅绿色变成浅紫色,且半分钟内不褪色。

 备战中考寒假系列答案
备战中考寒假系列答案【题目】除去下列物质内所含的杂质(括号内的物质),所选用的试剂不正确的是 ( )
A.乙酸(苯甲酸):NaOH溶液B.甲烷(乙烯):溴水
C.苯(苯甲酸):NaOH溶液D.乙炔(硫化氢):亚硫酸钠酸性溶液
【题目】解决能源短缺问题,工业生产中应合理利用化学能。
(1)25 ℃、1.01×105 Pa时,实验测得,4 g氢气在O2中完全燃烧生成液态水,放出572 kJ的热量,则表示H2的燃烧热的热化学方程式为______________________。
(2)从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程。
化学键 | H—H | N—H | N≡N |
键能/kJ·mol-1 | 436 | a | 945 |
已知:N2(g)+3H2(g)===2NH3(g) ΔH=-93 kJ·mol-1。试根据表中所列键能数据计算a的数值____________。
(3)已知:C(s,石墨)+O2(g)===CO2(g)ΔH1=-393.5 kJ·mol-1 ①
2H2(g)+O2(g)===2H2O(l)ΔH2=-571.6 kJ·mol-1 ②
2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l)ΔH3=-2599 kJ·mol-1 ③
根据盖斯定律,计算反应2C(s,石墨)+H2(g)===C2H2(g) ΔH=________。
【题目】氮的氧化物(如NO2、NO4、N2O5等)应用很广,在一定条件下可以相互转化。
(1) 已知:2NO(g)+O2(g)===2NO2(g) ΔH1
NO(g)+O3(g)===NO2(g)+O2(g) ΔH2
2NO2(g)![]() N2O4(g) ΔH3
N2O4(g) ΔH3
2N2O5(g)===4NO2(g)+O2(g) ΔH4
则反应N2O4(g)+O3(g)===N2O5(g)+O2(g)的ΔH=__________。
(2)从N2O5在一定条件下发生分解:2N2O5(g)===4NO2(g)+O2(g)。某温度下测得恒容密闭容器中N2O5浓度随时间的变化如下表:
t/min | 0.00 | 1.00 | 2.00 | 3.00 | 4.00 | 5.00 |
c(N2O5)/ (mol·L-1) | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
设反应开始时体系压强为p0,第2.00 min时体系压强为p,则p∶p0=________;1.00~3.00 min内,O2的平均反应速率为________。
(3)N2O4与NO2之间存在反应N2O4(g)![]() 2NO2(g)。将一定量的N2O4放入恒容密闭容器中,测得其平衡转化率[α(N2O4)]随温度变化如图所示。
2NO2(g)。将一定量的N2O4放入恒容密闭容器中,测得其平衡转化率[α(N2O4)]随温度变化如图所示。

①图中a点对应温度下,已知N2O4的起始压强p0为108 kPa,列式计算该温度下反应的平衡常数Kp=________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
②由图推测N2O4(g)![]() 2NO2(g)是吸热反应还是放热反应,说明理由_______________,若要提高N2O4转化率,除改变反应温度外,其他措施有____________(要求写出两条)。
2NO2(g)是吸热反应还是放热反应,说明理由_______________,若要提高N2O4转化率,除改变反应温度外,其他措施有____________(要求写出两条)。
【题目】甲醇是重要的工业原料。煤化工可以利用煤炭制取水煤气从而合成甲醇:CO(g)+2H2(g)![]() CH3OH(g)。
CH3OH(g)。
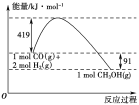
已知①常压下反应的能量变化如图所示。
②
化学键 | H—H | H—O | O===O |
键能kJ/mol | 436 | x | 496 |
③CO(g)+1/2O2(g)===CO2(g)ΔH=-280 kJ/mol;
H2(g)+1/2O2(g)===H2O(l) ΔH=-284 kJ/mol
H2O(l)===H2O(g) ΔH=+44 kJ/mol
请回答下列问题:
(1)请写出表示气态甲醇燃烧热的热化学方程式_______________________。
(2)H—O键的键能x为________ kJ/mol。
(3)甲醇气体分解为CO和H2两种气体的反应的活化能为________ kJ/mol。
(4)在____(填“高温”或“低温”)情况下有利于CO和H2制备甲醇的反应自发进行。
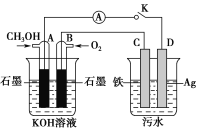
(5)某兴趣小组同学利用甲醇燃料电池探究电浮选法处理污水的一种方式:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀。Fe(OH)3具有吸附性,可吸附污物而沉积下来,具有净化水的作用。装置如图所示。
甲 乙
①写出甲池的A极电极反应式:__________________________。
②若乙池实验时污水中离子浓度较小,导电能力较差,净水效果不好,此时应向污水中加入适量的________。
A.H2SO4 B.BaSO4 C.Na2SO4 D.NaOH E.CH3CH2OH
