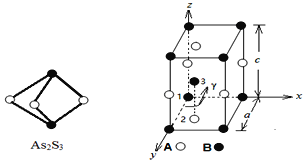
题目内容
【题目】氧化还原反应在生产生活中有很多实际应用:
Ⅰ.二氧化硒(SeO2)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或浓H2SO4反应生成SeO2以回收Se。
已知:①Se+2H2SO4(浓)=2SO2↑+SeO2+2H2O;②2SO2+SeO2+2H2O=Se+2SO![]() +4H+。
+4H+。
(1)Se与浓H2SO4的反应中,氧化剂是_______还原剂是________。
(2)依据反应①判断SeO2、浓H2SO4的氧化性强弱是:SeO2 ______ 浓H2SO4(填大于、小于或等于).
(3)用双线桥法标出反应②电子转移的方向和数目:_________________。
(4)SeO2、KI和HNO3发生如下反应,配平该反应的化学方程式____________。
SeO2+KI+HNO3→Se+I2+KNO3+H2O
Ⅱ.对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施。
(5)含氰废水中的CN-有剧毒。在微生物的作用下,CN-能够被氧气氧化成HCO![]() ,同时生成NH3,该反应的离子方程式为_____________________________________________。
,同时生成NH3,该反应的离子方程式为_____________________________________________。
(6)硫酸铜溶液能与单质磷反应:11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4反应中,被1mol CuSO4 氧化的P的物质的量__________。
【答案】浓硫酸或H2SO4 硒或Se 小于  SeO2+4KI+4HNO3=Se+2I2+4KNO3+2H2O 2CN-+4H2O+O2
SeO2+4KI+4HNO3=Se+2I2+4KNO3+2H2O 2CN-+4H2O+O2![]() 2HCO+2NH3 0.2mol
2HCO+2NH3 0.2mol
【解析】
(1)反应Se+2H2SO4(浓)=2SO2↑+SeO2+2H2O中,Se的化合价升高被氧化,做还原剂;浓硫酸中硫元素化合价降低被还原,做氧化剂。
(2)在氧化还原反应中氧化剂的氧化性强于氧化产物的氧化性,因此依据反应①以及(1)中分析可知SeO2、浓H2SO4的氧化性强弱是SeO2小于浓H2SO4。
(3)反应②中,2molSO2共失去4mol电子,失去的电子被SeO2得到,从而被还原为Se,故此反应转移4mol电子,用双线桥法标出电子转移的方向和数目为 。
。
(4)在反应SeO2+KI+HNO3→Se+I2+KNO3+H2O中,SeO2得4个电子,而KI失1个电子,根据得失电子数守恒可知,SeO2的计量数为1,而KI的计量数为4,故Se的计量数为1,I2的计量数为2,根据质量守恒可知,KNO3的计量数为4,则HNO3的计量数为4,水的计量数为2,故方程式为SeO2+4KI+4HNO3=Se+2I2+4KNO3+2H2O。
(5)含氰废水中的CN-有剧毒。在微生物的作用下,CN-能够被氧气氧化成HCO3-,同时生成NH3,反应中N元素化合价从+2价升高到+4价,失去2个电子,1分子氧气得到4个电子,根据电子得失守恒、原子守恒以及电荷守恒可知该反应的离子方程式为2CN-+4H2O+O2![]() 2HCO+2NH3。
2HCO+2NH3。
(6)反应11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4中铜元素化合价从+2价降低到+1价,得到1个电子,P元素化合价从0价升高到+5价,失去5个电子,则根据电子得失守恒可知被1molCuSO4氧化的P的物质的量是1mol÷5=0.2mol。

 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
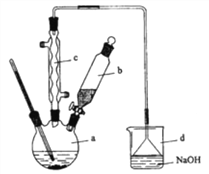
步步高口算题卡系列答案【题目】溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
苯 | 溴 | 溴苯 | |
密度/g·cm-3 | 0.88 | 3.10 | 1.50 |
沸点/℃ | 80 | 59 | 156 |
水中溶解度 | 微溶 | 微溶 | 微溶 |
按下列合成步骤回答问题:
(1)在a中加入15mL无水苯和少量铁屑。在b中小心加入4.0mL液态溴。向a中滴入几滴溴,有白色烟雾产生。请分别写出a仪器和c仪器的名称:_________________________、________________________________。
(2)请写出a中发生反应的化学方程式:___________________。d中倒置漏斗的作用是:_____,某同学认为如果想验证该反应的类型,可以取反应后烧杯d中溶液,加入稀硝酸酸化,然后加入硝酸银溶液,如果产生了淡黄色沉淀即验证了该反应的类型。试分析该同学的操作是否可行:______(填“是”或“否”),简要说明其原因:________________________。
(3)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用10mL水、8mL10%的NaOH溶液、10mL水洗涤。
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤。
经以上分离操作后,粗溴苯中还含有的主要杂质为___,要进一步提纯,下列操作中必须的是____(填入正确选项前的字母);
A.重结晶 B.过滤 C.蒸馏 D.萃取