题目内容
18.同温同压下的两个相同容器中分别装有NO和NO2气体,则两瓶气体中,原子数之比是2:3,质量之比是15:23,密度之比是15:23分子数之比是1:1.分析 同温同压下气体的气体摩尔体积相等,根据n=$\frac{V}{{V}_{m}}$=$\frac{m}{M}$=$\frac{N}{{N}_{A}}$结合分子构成计算.
解答 解:同温同压下的两个相同容器中分别装有NO和NO2气体,由于同温同压下气体的气体摩尔体积相等,由n=$\frac{V}{{V}_{m}}$可知,气体的分子数相等,比值为1:1,则原子数为2:3,质量比等于摩尔质量之比,为15:23,密度之比等于摩尔质量之比等于15:23.
故答案为:2:3;15:23;15:23;1:1.
点评 本题考查物质的量的计算,为高频考点,侧重于学生的分析能力和计算能力的考查,注意把握相关物理量与计算公式的运用,难度不大.

练习册系列答案
相关题目
8.某气体的摩尔质量为M,分子质量为m.若1摩尔该气体的体积为Vm,密度为ρ,则该气体单位体积分子数为(阿伏伽德罗常数为NA)( )
| A. | $\frac{{N}_{A}}{{V}_{m}}$ | B. | $\frac{M}{m{V}_{m}}$ | C. | $\frac{ρ{N}_{A}}{M}$ | D. | $\frac{ρ{N}_{A}}{m}$ |
9.埋在地下的钢管道可以用如图所示方法进行电化学保护.下列说法正确的是( )

| A. | 该方法将电能转化成化学能 | |
| B. | 在此装置中钢管道作正极 | |
| C. | 该方法称为“外加电流的阴极保护法” | |
| D. | 镁块上发生的电极反应为O2+2H2O+4e-═4OH- |
13.异构体  (b)、
(b)、 (d)、
(d)、 (p)的分子式均为C6H6,下列说法正确的是( )
(p)的分子式均为C6H6,下列说法正确的是( )
 (b)、
(b)、 (d)、
(d)、 (p)的分子式均为C6H6,下列说法正确的是( )
(p)的分子式均为C6H6,下列说法正确的是( )| A. | b的同分异构体只有d和q两种 | |
| B. | b、d、p中只有b的所有原子处于同一平面 | |
| C. | b、d、p均可与酸性高锰酸钾溶液反应 | |
| D. | b、d、p的二氯代物均只有3种 |
3.运用元素周期律分析下面推断,其中错误的是( )
| A. | 硒化氢(H2Se)是有毒的气体,比H2S稳定 | |
| B. | 砹为有色固体,HAt不稳定 | |
| C. | 硫酸锶(SrSO4)是难溶于水的白色固体 | |
| D. | 铍(Be)的氧化物的水化物可能具有两性 |
10.X元素的阳离子和Y元素的阴离子具有与氩元素相同的电子层结构.下列叙述正确的是( )
| A. | X的核电荷数比Y的小 | |
| B. | X的最高价氧化物一定是X2O,Y的气态氢化物为H2Y | |
| C. | X的离子半径比Y的大 | |
| D. | X的最高化合价比Y的低 |
8.下列除去杂质(括号内物质为少量杂质)的方法中,正确的是( )
| A. | 乙醇(水):加入浓硫酸,分液 | B. | 苯(溴):用NaOH溶液洗涤,分液 | ||
| C. | CO2(SO2):通过NaOH溶液,洗气 | D. | 铁(铝):加足量稀硫酸,过滤 |
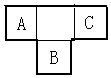 A、B、C为短周期元素,在周期表中所处的位置如图所示,A、C两元素的原子核外电子数之和等于B原子的质子数,B原子核内质子数和中子数相等.且含B元素物质的大量燃烧是形成酸雨的主要原因之一.
A、B、C为短周期元素,在周期表中所处的位置如图所示,A、C两元素的原子核外电子数之和等于B原子的质子数,B原子核内质子数和中子数相等.且含B元素物质的大量燃烧是形成酸雨的主要原因之一.  ,用电子式表示元素B的钠盐的形成过程:
,用电子式表示元素B的钠盐的形成过程: .
.