题目内容
7.在标准状况下,35.5g氯气的体积是11.2L,将其与氢气完全化合,需氢气的物质的量是0.5mol.分析 标况下,气体摩尔体积是22.4L/mol,根据V=$\frac{m}{M}$计算氯气体积,氯气和氢气反应方程式为Cl2+H2$\frac{\underline{\;点燃\;}}{\;}$2HCl,根据氯气和氢气之间关系式计算需要氢气物质的量
解答 解:标况下,气体摩尔体积是22.4L/mol,(Cl2)=$\frac{35.5g}{71g/mol}$=0.5mol,
V(Cl2)=nVm=0.5mol×22.4L/mol=11.2L,氯气和氢气反应方程式为Cl2+H2$\frac{\underline{\;点燃\;}}{\;}$2HCl,根据氯气和氢气之间关系式得需要n(H2)=n(Cl2)=0.5mol;
故答案为:11.2;0.5.
点评 本题考查物质的量有关计算,明确各个物理量关系是解本题关键,熟练掌握物质的量基本公式并灵活运用,题目难度不大.

练习册系列答案
相关题目
17.运用元素周期律分析下面的推断,其中不正确的是( )
| A. | 在氧气中,铷(Rb)的燃烧产物比钠的燃烧产物更复杂 | |
| B. | 砹(At)为有色固体,AgAt难溶于水也不溶于稀硝酸 | |
| C. | 由水溶液的酸性:HCl>H2S,可推断出元素的非金属性:Cl>S | |
| D. | 硅、锗都位于金属与非金属的交界处,都可以做半导体材料 |
15.下列关于苯(如图所示)的叙述正确的是( )


| A. | 反应②不发生,但是仍有分层现象,紫色层在下层 | |
| B. | 反应①常温下能进行,其有机产物为 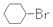 | |
| C. | 反应③为加成反应,产物是三硝基甲苯 | |
| D. | 反应④中1mol苯最多与3 mol H2发生加成反应,是因为苯分子含有三个碳碳双键 |
12.化合物G(结构如图)是合成抗癌药氨柔比星的中间体.下列说法正确的是( )


| A. | 该有机物的分子式为C12H15NO4 | |
| B. | 该有机物分子中所有原子一定在同一平面上 | |
| C. | 该有机物可以发生取代、加成和氧化反应 | |
| D. | 该有机物既可与NaHCO3溶液反应,又可与NaOH溶液反应 |
19.下列有关物质的性质、制取或应用等说法正确的是( )
| A. | 乙烯能发生加成反应,可用于合成塑料 | |
| B. | 在工业上,通过分馏石油可得到甲烷、乙烯、苯 | |
| C. | 实验室用苯和溴水混合,并加铁粉制取溴苯 | |
| D. | 可利用丁达尔效应来区别葡萄糖和蔗糖溶液 |
1.1869年,俄国化学家门捷列夫制作出了第一张元素周期表,揭示了化学元素间的内在联系,成为化学史上的重要里程碑之一.下列有关元素周期表的说法正确的是( )
| A. | 元素周期表有18个族 | |
| B. | 元素周期表的第8、9、10三纵列合称Ⅷ族,Ⅷ族是元素周期表所有族中元素种类最多的族 | |
| C. | 一般在过渡元素中寻找一些化学反应新型催化剂 | |
| D. | 元素周期表中的所有副族元素都是金属元素,副族包含过渡元素和Ⅷ族 |