题目内容
3.运用元素周期律分析下面推断,其中错误的是( )| A. | 硒化氢(H2Se)是有毒的气体,比H2S稳定 | |
| B. | 砹为有色固体,HAt不稳定 | |
| C. | 硫酸锶(SrSO4)是难溶于水的白色固体 | |
| D. | 铍(Be)的氧化物的水化物可能具有两性 |
分析 A.非金属性S>Se,非金属性越强,对应氢化物越稳定;
B.At的非金属性较弱,卤素单质的颜色从上到下加深;
C.Ca、Sr同主族,硫酸钙不溶于水;
D.Be与Al位于对角线位置,元素化合物性质相似.
解答 解:A.非金属性S>Se,非金属性越强,对应氢化物越稳定,则硒化氢(H2Se)是有毒的气体,不如H2S稳定,故A错误;
B.At的非金属性较弱,卤素单质的颜色从上到下加深,则砹为有色固体,HAt不稳定,故B正确;
C.Ca、Sr同主族,硫酸钙不溶于水,则硫酸锶(SrSO4)是难溶于水的白色固体,故C正确;
D.Be与Al位于对角线位置,氧化物性质相似,则铍(Be)的氧化物的水化物与氢氧化铝性质相似,均具有两性,故D正确;
故选A.
点评 本题考查元素周期表和周期律,为高频考点,把握元素的位置、性质、元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案
相关题目
13.下列仪器使用正确的是( )
| A. | 在表面皿蒸发浓缩NaCl溶液 | |
| B. | 用带玻璃塞的试剂瓶盛盐酸 | |
| C. | 使用漏斗、滤纸、玻璃棒、烧杯等进行过滤实验 | |
| D. | 配制100mL浓度为0.10 mol•L-1NaCl溶液时,在容量瓶中溶解、定容 |
11.下列关于乙酸的叙述正确的是( )
| A. | 乙酸酸性较弱,不能使紫色石蕊变红 | |
| B. | 乙酸在常温下能与NaOH、Na2CO3、乙醇等发生化学反应 | |
| C. | 在发生酯化反应时,乙酸分子羟基中的氢原子跟醇分子中的羟基结合成水 | |
| D. | 乙酸分子中既有极性键,又有非极性键 |
8.由铁、石墨、稀盐酸组成的原电池工作时,下列叙述正确的是( )
| A. | 铁电极为负极 | B. | 石墨电极为负极 | ||
| C. | 氢离子向铁电极移动 | D. | 正极发生氧化反应 |
15.下列关于苯(如图所示)的叙述正确的是( )


| A. | 反应②不发生,但是仍有分层现象,紫色层在下层 | |
| B. | 反应①常温下能进行,其有机产物为 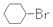 | |
| C. | 反应③为加成反应,产物是三硝基甲苯 | |
| D. | 反应④中1mol苯最多与3 mol H2发生加成反应,是因为苯分子含有三个碳碳双键 |
12.化合物G(结构如图)是合成抗癌药氨柔比星的中间体.下列说法正确的是( )


| A. | 该有机物的分子式为C12H15NO4 | |
| B. | 该有机物分子中所有原子一定在同一平面上 | |
| C. | 该有机物可以发生取代、加成和氧化反应 | |
| D. | 该有机物既可与NaHCO3溶液反应,又可与NaOH溶液反应 |
13.《本草纲目》记载了烧酒的制造工艺:“凡酸坏之杯,皆可蒸烧”,“以烧酒复烧二次…价值数倍也”,此方法的原理是( )
| A. | 过滤 | B. | 萃取 | C. | 结晶 | D. | 蒸馏 |
 一种石英晶体的晶胞结构如图所示,可以看成是在晶体硅的晶胞中每两个硅原子间插入一个氧原子而得到.其中硅原子的配位数为4;若该晶胞的晶胞参数为a pm,则该晶体的密度为
一种石英晶体的晶胞结构如图所示,可以看成是在晶体硅的晶胞中每两个硅原子间插入一个氧原子而得到.其中硅原子的配位数为4;若该晶胞的晶胞参数为a pm,则该晶体的密度为