题目内容
12.人工固氮是指将氮元素由游离态转化为化合态的过程.Ⅰ.最近一些科学家研究采用高质子导电性的SCY陶瓷(能传递H+)实验氮的固定---电解法合成氨,大大提高了氮气和氢气的转化率.总反应式为:N2+3H2$?_{一定条件}^{SCT陶瓷}$2NH3.则在电解法合成氨的过程中,应将H2不断地通入阳极(填“阴”或“阳”);向另一电极通入N2,该电极的反应式为N2+6H++6e-=2NH3.
Ⅱ.据报道,在一定条件下,N2在掺有少量氧化铁的二氧化钛催化剂表面能与水发生反应,主要产物为NH3,相应的反应方程式为:2N2(g)+6H2O(g)═4NH3(g)+3O2(g)△H=Q
(1)上述反应的平衡常数表达式为$\frac{{c}^{4}(N{H}_{3})×{c}^{3}({O}_{2})}{{c}^{2}({N}_{2})×{c}^{2}({H}_{2}O)}$.
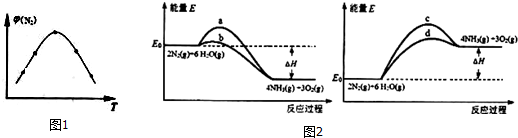
(2)取五份等体积N2和H2O的混合气体(物质的量之比均为1:3),分别加入体积相同的恒容密闭容器中,在温度不相同的情况下发生反应,反应相同时间后,测得氮气的体积分数φ(N2)与反应温度T的关系曲线如图1所示,则上述反应的Q>0(填“>”、“<”或“=”).
(3)若上述反应在有催化剂的情况下发生,则如图2所示的a、b、c、d四条曲线中,能表示反应体系能量变化的是d(填字母代号),图中△H绝对值为1530kJ•mol-1.
Ⅲ.目前工业合成氨的原理是:N2(g)+3H2(g)═2NH3(g)△H=-93.0KJ/mol.
回答下列问题:
(1)结合II中的数据,则2H2(g)+O2(g)=2H2O(g) 的△H=-572KJ/mol.
(2)在一定温度下,将1molN2和3mol H2混合置于体积不变的密闭容器中发生反应,达到平衡状态时,测得气体总物质的量为2.8mol.
①达平衡时,H2的转化率a1=60%.
②在相同条件下,若起始时只将NH3置于该容器中,达到平衡状态时NH3的转化率为a2,当a1+a2=1时,则起始时NH3的物质的量n(NH3)2mol.
分析 Ⅰ.在电解法合成氨的过程中,氢气发生氧化反应,应在阳极通入,氮气发生还原反应,在阴极通入,阴极上是氮获得电子,与质子结合生成氨气;
Ⅱ.(1)平衡常数为生成物平衡浓度化学计量数幂乘积与反应物平衡浓度化学计量数幂乘积的比;
(2)开始未到达平衡,氮气体积分数最大时到达平衡状态,而后升高温度,氮气的体积分数减小,说明升高温度平衡正向移动,则正反应为吸热反应;
(3)正反应为吸热反应,则反应物总能量小于生成物总能量,使用催化剂降低活化能,而反应热只与始态、终态有关,催化剂不影响反应热;
Ⅲ.(1)①2N2(g)+6H2O(g)?4NH3(g)+3O2(g)△H═+1530kJ/mol,
②N2(g)+3H2(g)?2NH3(g)△H═-93.0kJ/mol
根据盖斯定律计算,(②×2-①)÷3得到:2H2(g)+O2(g)═2H2O(g),焓变也进行相应计算;
(2)①在一定温度下,将1molN2和3mol H2混合置于体积不变的密闭容器中发生反应,达到平衡状态时,测得气体总物质的量为2.8mol,设参加反应的氮气为xmol,则:
N2(g)+3H2(g)?2NH3(g)
起始量(mol):1 3 0
变化量(mol):x 3x 2x
平衡量(mol):1-x 3-3x 2x
再根据平衡时总物质的量列方程计算解答;
②在相同条件下,若起始时只将NH3置于该容器中,达到平衡状态时NH3的转化率为a2,当a1+a2=1时,则与原平衡为等效平衡,完全转化到左边满足1molN2和3mol H2.
解答 解:Ⅰ.在电解法合成氨的过程中,氢气发生氧化反应,应在阳极通入,氮气发生还原反应,在阴极通入,阴极上是氮获得电子,与质子结合生成氨气,阴极电极反应式为:N2+6H++6e-=2NH3,
故答案为:阳;N2+6H++6e-=2NH3;
Ⅱ.(1)2N2(g)+6H2O(g)?4NH3(g)+3O2(g)的平衡常数表达式K=$\frac{{c}^{4}(N{H}_{3})×{c}^{3}({O}_{2})}{{c}^{2}({N}_{2})×{c}^{2}({H}_{2}O)}$,故答案为:$\frac{{c}^{4}(N{H}_{3})×{c}^{3}({O}_{2})}{{c}^{2}({N}_{2})×{c}^{2}({H}_{2}O)}$;
(2)开始未到达平衡,氮气体积分数最大时到达平衡状态,而后升高温度,氮气的体积分数减小,说明升高温度平衡正向移动,则正反应为吸热反应,则△H>0,
故答案为:>;
(3)正反应为吸热反应,则反应物总能量小于生成物总能量,使用催化剂降低活化能,而反应热只与始态、终态有关,催化剂不影响反应热,图中曲线d符合,
故答案为:d;
Ⅲ.(1)①2N2(g)+6H2O(g)?4NH3(g)+3O2(g)△H═+1530kJ/mol,
②N2(g)+3H2(g)?2NH3(g)△H═-93.0kJ/mol
根据盖斯定律计算,(②×2-①)÷3得到:2H2(g)+O2(g)═2H2O(g)△H═-572KJ/mol;
故答案为:-572KJ/mol;
(2)①在一定温度下,将1molN2和3mol H2混合置于体积不变的密闭容器中发生反应,达到平衡状态时,测得气体总物质的量为2.8mol,设参加反应的氮气为xmol,则:
N2(g)+3H2(g)?2NH3(g)
起始量(mol):1 3 0
变化量(mol):x 3x 2x
平衡量(mol):1-x 3-3x 2x
故1-x+3-3x+2x=2.8,解得x=0.6,故氢气的转化率为$\frac{1.8mol}{3mol}$×100%=60%,
故答案为:60%;
②在相同条件下,若起始时只将NH3置于该容器中,达到平衡状态时NH3的转化率为a2,当a1+a2=1时,则与原平衡为等效平衡,完全转化到左边满足1molN2和3mol H2,则n(NH3)=2mol,
故答案为:2.
点评 本题考查化学平衡计算与影响因素、电解原理应用、等效平衡等,Ⅲ中(3)注意理解等效平衡规律,难度中等.

 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案| A. | 二氧化硅的分子式:SiO2 | |
| B. | 熔融状态下硫酸氢钾的电离方程式:KHSO4$\frac{\underline{\;熔融\;}}{\;}$K++HSO4- | |
| C. | 甲基的电子式: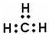 | |
| D. | HClO的结构式:H-Cl-O |
 )的一氯代产物有(不考虑立体异构)( )
)的一氯代产物有(不考虑立体异构)( )| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
| A. | 单位时间内,生成nmolH2的同时生成nmolHI | |
| B. | 一个H-H键断裂的同时,有2个H-I键断裂 | |
| C. | 温度和体积一定时,某一生成物浓度不再变化 | |
| D. | 温度和体积一定时,混合气体的颜色不再变化 |
 氯气的制取按照传统的方法,一般采用浓盐酸与MnO2共热来制备氯气,但是这种方法制过程中存在缺陷.某学习小组采用新的方法来制备氯气并进行性质实验.
氯气的制取按照传统的方法,一般采用浓盐酸与MnO2共热来制备氯气,但是这种方法制过程中存在缺陷.某学习小组采用新的方法来制备氯气并进行性质实验.
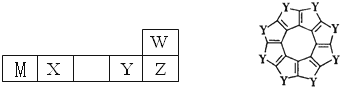 W、M、X、Y、Z五种短周期元素在周期表中的位置如图所示,其中只有M为金属元素,请回答下列问题:
W、M、X、Y、Z五种短周期元素在周期表中的位置如图所示,其中只有M为金属元素,请回答下列问题: