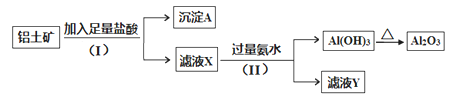
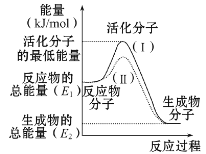
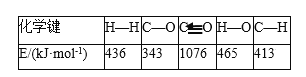
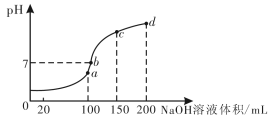
题目内容
【题目】某试剂瓶上贴有如下标签“100mL 1.0molL-1MgCl2 溶液”,对该试剂理解正确的是( )
A.该溶液中含有的微粒主要有:MgCl2、Mg2+、Cl-、H2O
B.若取 50mL 溶液,其中的 c(Cl-)=1 molL﹣1
C.取该溶液5.0 mL恰好与0.1 molL-1 AgNO3100 mL溶液完全反应
D.取10mL该溶液加水10 mL,所得MgCl2溶液的浓度为0.5 molL-1
【答案】C
【解析】
A选项,该溶液中含有的微粒主要有:Mg2+、Cl-、H2O,不含MgCl2,故A错误;
B选项,若取50 mL溶液,其中的c(Cl-)=2c(MgCl2) = 2×1 molL﹣1= 2 molL﹣1,故B错误;
C选项,取该溶液5.0 mL,5 mL溶液中氯离子物质的量![]() ,0.1 molL-1 AgNO3100 mL溶液中银离子物质的量
,0.1 molL-1 AgNO3100 mL溶液中银离子物质的量![]() ,两者物质的量相等,因此两者恰好完全反应,故C正确;
,两者物质的量相等,因此两者恰好完全反应,故C正确;
D选项,取10mL该溶液加水10 mL,由于溶液中加水,两者密度不相同,体积不能加和,因此溶液体积小于20 mL,所以得到的MgCl2溶液的浓度为大于0.5 molL-1,故D错误;
综上所述,答案为C。

练习册系列答案
相关题目