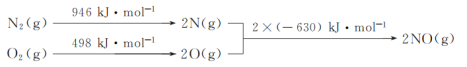题目内容
【题目】某工业废水中含有CN-和Cr2O![]() 等离子,需经污水处理达标后才能排放,污水处理厂拟用下列流程进行处理:
等离子,需经污水处理达标后才能排放,污水处理厂拟用下列流程进行处理:
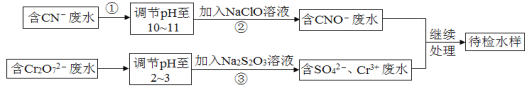
回答下列问题:
(1)步骤②中,CN-被ClO-氧化为CNO-的离子方程式为_______。
(2)步骤③的反应为![]() (未配平),则每反应0.1molCr2O72-时,消耗S2O32-_____mol。
(未配平),则每反应0.1molCr2O72-时,消耗S2O32-_____mol。
(3)含Cr3+废水可以加入熟石灰进一步处理,目的是______。
(4)在25℃下,将![]() 的NaCN溶液与0.01mol·L-1的盐酸等体积混合,反应后测得溶液pH=7,则a____0.01(填“>”、“<”或“=”);用含a的代数式表示HCN的电离常数Ka=____。
的NaCN溶液与0.01mol·L-1的盐酸等体积混合,反应后测得溶液pH=7,则a____0.01(填“>”、“<”或“=”);用含a的代数式表示HCN的电离常数Ka=____。
(5)取工业废水水样于试管中,加入NaOH溶液观察到有蓝色沉淀生成,继续加至不再产生蓝色沉淀为止,再向溶液中加入足量Na2S溶液,蓝色沉淀转化成黑色沉淀。该过程中反应的离子方程式是_______;________。
【答案】CN-+ClO-=CNO-+Cl- 0.075 调节废水pH,使其转化成Cr(OH)3沉淀除去 > (100a-1)×10-7 mol·L-1 Cu2++2OH-=Cu(OH)2↓ Cu(OH)2(s)+S2-(aq)=CuS(s)+2OH-(aq)
【解析】
本题考查的是物质分离和提纯的方法和基本操作综合应用。流程分析含CN-废水,调整溶液pH,加入NaClO溶液,氧化CN-离子反应生成CNO-的废水,含Cr2O72-的废水,调整溶液pH,加入Na2S2O3发生氧化还原反应,得到含硫酸根离子的废水和含CNO-的废水继续处理得待测水样。
(1)步骤②中,CN-被ClO-氧化为CNO-,因为是在碱性环境中,故ClO-只能被还原为Cl-,反应式为:CN-+ClO-═CNO-+Cl-;
(2)根据得失电子守恒配平方程式,根据方程式找出S2O32-和 Cr2O72-的关系,从而计算出每反应0.1molCr2O72-时,消耗S2O32-的物质的量;
(3)加入熟石灰进一步处理,调节废水pH,使其转化成Cr(OH)3沉淀除去;
(4)反应后测得溶液pH=7,则可推知NaCN过量,根据电荷守恒和物料守恒即可计算出CN-和HCN的浓度,进而计算出Ka;
(5)待检水样中还有Cu2+,加碱发生Cu2++2OH-═Cu(OH)2↓,再加入Na2S溶液,CuS比Cu(OH)2更难溶,则发生Cu(OH)2(s)+S2-(aq)═CuS(s)+2OH-(aq)。据此解答。
(1)碱性条件下,CN离子与NaClO发生氧化还原反应生成CNO、Cl离子,离子反应为:CN+ClO═CNO+Cl。本小题答案为:CN+ClO═CNO+Cl。
(2) 步骤③的反应为![]() ,S2O32-中S元素的化合价由+2价升高到+6价生成SO42-,过程中失4e-发生氧化反应,Cr2O72-中Cr元素的化合价由+6价降低到+3价生成Cr3+,过程中得3e-发生还原反应,根据得失电子守恒,S2O32-和 Cr2O72-的物质的量之比为3:4,则每反应0.1molCr2O72-时,消耗S2O32-为0.075mol。本小题答案为:0.075。
,S2O32-中S元素的化合价由+2价升高到+6价生成SO42-,过程中失4e-发生氧化反应,Cr2O72-中Cr元素的化合价由+6价降低到+3价生成Cr3+,过程中得3e-发生还原反应,根据得失电子守恒,S2O32-和 Cr2O72-的物质的量之比为3:4,则每反应0.1molCr2O72-时,消耗S2O32-为0.075mol。本小题答案为:0.075。
(3)Cr3+废水有毒,可使Cr3+生成沉淀过滤除去,故调节废水pH,使其转化成Cr(OH)3沉淀除去。本小题答案为:调节废水pH,使其转化成Cr(OH)3沉淀除去。
(4) 由于反应后测得溶液pH=7,当a=0.01时,恰好反应,生成了氰化氢溶液,溶液显示酸性,则氰化钠应该多些,故a>0.01;由电荷守恒c(Na+)+c(H+)=c(OH)+c(CN)+c(Cl)及pH=7,可知c(H+)=c(OH)=107molL1,c(CN)=c(Na+)c(Cl)=a/2mol/L0.01/2mol/L,再根据物料守恒:c(CN)+c(HCN)=c(Na+)=a/2mol/L;Ka﹦c(H+)c(CN)/c(HCN)=107×(a/20.01/2)/0.01/2=(100a1)×107molL1。本小题答案为:>;(100a1)×107molL1。
(5)蓝色沉淀为Cu(OH)2,CuS(s)比Cu(OH)2(s)更难溶,发生了沉淀的转化,涉及的离子反应方程式为Cu2++2OH═Cu(OH)2↓、Cu(OH)2(s)+S2(aq)═CuS(s)+2OH(aq)。本小题答案为:Cu2++2OH═Cu(OH)2↓;Cu(OH)2(s)+S2(aq)═CuS(s)+2OH(aq)。

 名校课堂系列答案
名校课堂系列答案【题目】Ⅰ.在1.0 L密闭容器中放入0.10molA(g),在一定温度进行如下反应:A(g)![]() 2B(g)+C(g)+D(s) △H= +85.1kJ·mol-1,容器内气体总压强(P)与起始压强P0的比值随反应时间(t)数据见下表:
2B(g)+C(g)+D(s) △H= +85.1kJ·mol-1,容器内气体总压强(P)与起始压强P0的比值随反应时间(t)数据见下表:
时间t/ h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 |
| 1.00 | 1.50 | 1.80 | 2.20 | 2.30 | 2.38 | 2.40 | 2.40 |
回答下列问题:
(1)下列能提高A的转化率的是____。
A 升高温度 B 体系中通入A气体
C 将D的浓度减小 D 通入稀有气体He,使体系压强增大到原来的5倍
E 若体系中的C为HCl,其它物质均难溶于水,滴入少许水
(2)该反应的平衡常数表达式K=___;前2小时C的反应速率是____;计算平衡时A的转化率_____。
(3)若将容器改为恒压容器,改变条件,使反应达到与上述相同的转化率,则达到平衡时B浓度为____。(保留两位有效数字)
Ⅱ.锂的化合物用途广泛。Li3N是非常有前途的储氢材料;LiFePO4、Li2FeSiO4等可以作为电池的正极材料。请回答下列问题:
(4)氮化锂在氢气中加热时可得到氨基锂(LiNH2),其反应的化学方程式为:Li3N+2H2![]() LiNH2+2LiH,在270℃时,该反应可逆向发生放出H2,因而氮化锂可作为储氢材料,储存氢气最多可达Li3N质量的____%(精确到0.1%)。
LiNH2+2LiH,在270℃时,该反应可逆向发生放出H2,因而氮化锂可作为储氢材料,储存氢气最多可达Li3N质量的____%(精确到0.1%)。
(5)将Li2CO3、FeC2O4·2H2O和SiO2粉末均匀混合,在800℃的氩气中烧结6小时制得Li2FeSiO4,写出该反应的化学方程式______。
(6)磷酸亚铁锂电池稳定性高、安全、对环境友好,该电池在充放电过程中,发生LiFePO4与Li1-xFePO4之间的转化,电池放电时负极发生的反应为LiXC6-xe- =xLi++6C,写出电池放电时的化学方程式____。