��Ŀ����
����Ŀ��NH3��һ����Ҫ�Ļ���ԭ�ϡ�
(1)��ͬ�¶ȡ�ѹǿ��.�ϳɸ�ƽ����ϵNH3�����ʵ���������ͼ (N2��H2����ʼ���ʵ���֮��Ϊ1:3)��
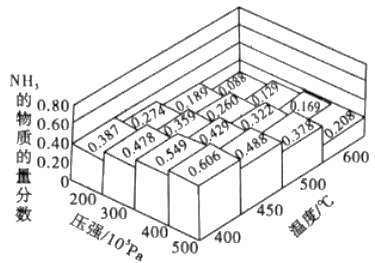
�ٷ���ͼ�����ݣ������¶ȣ��÷�Ӧ��ƽ�ⳣ��Kֵ____(�������С�����䡱)��
�������ʼʱ���ܱ�������Ͷ��1.0mol N2 ��3.0mol H2������500�桢3��107Pa�����´ﵽƽ��ʱN2 ��ƽ��ת����=_______��(������λ��Ч����)
��Һ����ˮ��Ϊ���������ܽ���������л����ӣ�����뷽��ʽ�ɱ�ʾΪ2NH3 ![]() NH4++ NH2һ(ij�¶��������ӻ�����Ϊ10-30)��Һ���е�pNH4��ˮ�е�pH���ƣ�����¶���Һ����pNH4=____��
NH4++ NH2һ(ij�¶��������ӻ�����Ϊ10-30)��Һ���е�pNH4��ˮ�е�pH���ƣ�����¶���Һ����pNH4=____��
(2)�������������з������ȼ�ϵ���ǵ�ǰ���е�һ���ȵ㡣��ȼ�ϵ��ʹ�õĵ������Һ��KOH��Һ���õ�ظ����ĵ缫��ӦʽΪ_________________��
(3)NH3Ҳ�����ˮ�帻Ӫ��������Ҫ����֮һ���ô�������ˮ�����ɵĴ����Ὣˮ�е�NH3ת��Ϊ������ȥ������ط�Ӧ���Ȼ�ѧ����ʽ����:
��ӦI: NH3 (aq)+HClO(aq)=NH2Cl(aq)+H2O(l) ��H1=akJ/mol��
��ӦII :NH2Cl(aq)+HClO(aq)=NHCl2(aq) +H2O(l) ��H2=bkJ/mol��
��ӦIII: 2NHCl2(aq) +H2O(l)=N2(g)+HClO( aq)+3HCl( aq) ��H3=ckJ/mol��
��2NH3(aq)+3HClO(aq)==N2 (g)+3HCl(aq)+3H2O(l) ��H=________kJ/mol
����֪��ˮ��Һ��NH2Cl���ȶ���NHCl2���ȶ���ת��Ϊ�������������������������£��ı�![]() ����Һ�д�������ȥ����Ч��������(��Һ��+1����Ԫ�صĺ���)��Ӱ����ͼ��ʾ��a��֮ǰ��Һ�з�������Ҫ��ӦΪ_______(�����)��
����Һ�д�������ȥ����Ч��������(��Һ��+1����Ԫ�صĺ���)��Ӱ����ͼ��ʾ��a��֮ǰ��Һ�з�������Ҫ��ӦΪ_______(�����)��
A.��ӦI��I I B.��ӦI

�۳�������������ѵ�![]() ֵԼΪ______________��
ֵԼΪ______________��
���𰸡� ��С 41% 15 2NH3 6e + 6OH=N2 + 6H2O 2a��2b��c B 1.5
����������1�����黯ѧƽ�ⳣ����ת���ʵļ��㡢pH�ļ��㣬�ٸ���ͼ�������¶ȵ����ߣ�NH3������������С��˵������Ӧ�����Ƿ��ȷ�Ӧ���������¶ȣ�ƽ�ⳣ��K��С����
N2��3H2![]() 2NH3
2NH3
��ʼ�� 1 3 0
�仯�� x 3x 2x
ƽ�⣺1��x 3��3x 2x ��500�桢3��107PaʱNH3����������Ϊ0.26����2x/(1��x��3��3x��2x)=0.26�����x=0.41����N2��ת����Ϊ41%���۸���ˮ�����ӻ���c(NH4��)��c(NH2��)=10��30����c(NH4��)=c(NH2��)���Ƴ�c(NH4��)=10��15mol��L��1����˸��¶���pNH4=15����2������缫��Ӧʽ����д����Ϊ�������Դ�����NH3��N2������ԭ��صĹ���ԭ����NH3�ڸ����ϲ��뷴Ӧ�������ΪKOH��Һ����˸�����ӦʽΪ2NH3��6e����6OH��=N2��6H2O����3�������Ȼ�ѧ��Ӧ����ʽ�ļ��㡢��ѧ��Ӧ������ѡ�ٷ�ӦI��2����ӦII��2����ӦIII���ó���Ŀ�귽��ʽ�ġ�H=(2a��2b��c)kJ��mol��1����a��֮ǰ������������٣����������࣬��˷�����ӦI����ѡ��B��ȷ����ȥ���ʽϸߣ�ͬʱ���������٣�ͼ���з��ϵı�ֵΪ1.5��

����Ŀ����������(POCl3)��һ����Ҫ�Ļ���ԭ�ϣ���ҵ�Ͽ���ֱ������PCl3�Ʊ�POCl3����Ӧԭ��Ϊ��P4(����)+6Cl2=4PCl3 2PCl3+O2=2POCl3
PCl3��POCl3�IJ����������£�
�۵�/�� | �е�/�� | ���� | |
PCl3 | -112 | 75.5 | ��ˮ����H3PO3��HCl |
POCl3 | 2 | 105.3 | ��ˮ����H3PO4��HCl |
ij��ȤС��ģ��ù������ʵ��װ������(ijЩ�г�װ�á�����װ������ȥ) ��
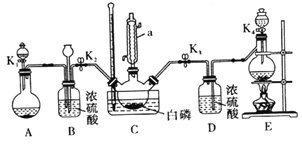
(1)����a ������Ϊ_______________��Bװ���г���©����������___________________��
(2)װ��E������ȡCl2����Ӧ�����ӷ���ʽΪ_____________________��
(3)Ϊʹʵ��˳�����У����貹���װ��Ϊ____________________��
(4)��Ӧʱ�����ϸ��������������
������ȡ___________��������ͨ��C �У�ֱ��C �еİ�����ʧ����ͨ����һ�����塣
��Cװ����ˮԡ���ȿ����¶�Ϊ60 �桫65�棬���ӿ췴Ӧ�����⣬��һĿ����___________________��
�۷�Ӧ��������������C װ���в��������İ���������Ҫ�ɷ�Ϊ___________(д��ѧʽ)��
(5)��Ӧ������ͨ�����沽��ⶨPOCl3��Ʒ��Cl �ĺ�����Ԫ��Cl ����������Ϊ_______________(д������ʽ)��
��.ȡxg��Ʒ����ƿ�У���������NaOH ��Һ��POCl3��ȫ��Ӧ���ϡ���������ԣ�
��.����ƿ�м���0.1000 mol/L ��AgNO3 ��Һ40.00 mL��ʹCl-��ȫ������
��.������ƿ�м���20mL����������ʹ�������汻�л��︲�ǣ�
��.Ȼ�����ָʾ������c mol/LNH4SCN��Һ�ζ�����Ag+ ���յ㣬�����������ΪVmL��
(��֪��AgPO4�����ᣬKsp(AgCl )=32��10-10��Ksp(AgSCN )=2��10-12)