题目内容
【题目】如图为长式周期表的一部分,其中的编号代表对应的元素. 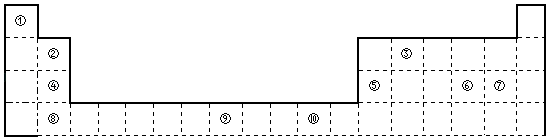
请回答下列问题:
(1)③和①形成的一种5核10电子分子,其立体构型为 , 中心原子杂化方式为 , 属于分子(填“极性”或“非极性”).
(2)元素③和⑦的最高价氧化物对应水化物中酸性较强的是:(填化学式)元素⑥的电负性元素⑦(选填“>”、“=”、“<”=)的电负性.
(3)根据元素周期表分区,元素⑨位于区,其基态原子电子排布式为 .
(4)某些不同族元素的性质也有一定的相似性,如上表中元素②与元素⑤的氢氧化物有相似的性质.请写出元素②的氢氧化物与NaOH溶液反应的离子方程式 .
【答案】
(1)正四面体形; sp3;非极性
(2)HClO4;<
(3)d;1s22s22p63s23p63d64s2
(4)Be(OH)2+2OH﹣=BeO22﹣+2H2O
【解析】解:由元素在周期表的位置可知,①为H,②为Be,③为C,④为Mg,⑤为Al,⑥为S,⑦为Cl,⑧为Ca,⑨为Fe,⑩为Cu,(1)C和H形成的一种5核10电子分子为CH4,CH4分子中的C原子价层电子对个数是4,则C原子采取sp3杂化,立体构型为正四面体形,分子中正负电荷重心重合,为非极性分子;
所以答案是:正四面体形;sp3;非极性;(2)C的非金属性小于Cl的非金属性,最高价氧化物对应水化物中酸性较强的是HClO4;同周期自左到右电负性减小,所以电负性:S<Cl;
所以答案是:HClO4;<; (3)d区元素包含周期表中3﹣10列元素,上述元素中只有⑨号元素属于d区;为Fe,为26号元素,原子核外有26个电子,根据能量最低原理,其核外电子排布式为:1s22s22p63s23p63d64s2;
所以答案是:d;1s22s22p63s23p63d64s2;(4)元素⑤为Al,Al(OH)3具有两性,元素②为Be,元素⑤与元素②的氢氧化物有相似的性质,故Be(OH)2也具有两性,能与NaOH反应,方程式为:Be(OH)2+2NaOH=Na2BeO2+2H2O,离子方程式为:Be(OH)2+2OH﹣=BeO22﹣+2H2O;
所以答案是:Be(OH)2+2OH﹣=BeO22﹣+2H2O;

 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案 出彩同步大试卷系列答案
出彩同步大试卷系列答案【题目】填写下列空格。
(1)已知拆开1molH-H键、1molCl-Cl键、1molH-Cl键分别需要吸收的能量为436.4kJ、242.7kJ、431.8kJ。则由H2和Cl2反应生成1molHCl需要_____(填“放出”或“吸收”)____kJ的热量。
(2)H2可以在Cl2中安静地燃烧。甲、乙两图中,能表示该反应能量变化的是图_____(填“甲”或“乙”)。

(3)已知:H2与Cl2在光照条件下会发生爆炸。同温同压下,反应H2(g)+Cl2(g)=2HCl(g)。在光照和点燃条件下的H_____(填“相等”或“不相等”)。
(4)硅、磷、硫、氯元素的气态氢化物的形成条件和热稳定性如下表所示:
元素符号 | Si | P | S | Cl |
单质与氢气的反应 | 高温下反应 | 磷蒸气与氢气能反应 | 加热时反应 | 光照或点燃时发生爆炸而化合 |
气态氢化物的热稳定性 | 不稳定 | 不稳定 | 受热分解 | 稳定 |
结合元素原子结构等知识,分析以上信息可得出的结论是:同周期非金属元素,随着元素核电荷数的递增,____________________________________,因此,Si、P、S、Cl非金属性依次增强。