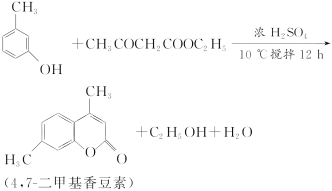
题目内容
【题目】在一个密闭绝热容器(W)中,进行如下两个可逆反应:①A(g)+2B(g)![]() 3C(g)+D(s)△H1>0,②xM(g)+N(g)
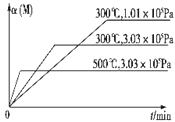
3C(g)+D(s)△H1>0,②xM(g)+N(g)![]() 3Q(g)△H2.反应①中各物质与反应②中各物质均不发生反应. M的转化率与温度、压强的关系如图所示.
3Q(g)△H2.反应①中各物质与反应②中各物质均不发生反应. M的转化率与温度、压强的关系如图所示.
下列对W容器中进行的反应推断合理的是( )
A.x=2
B.平衡时, v 正 (B):v 逆 (C)=2:3
C.若保持容器容积不变,充入N,则C的物质的量减小
D. 若保持容器容积不变,充入Q,反应①的平衡常数不变
【答案】B
【解析】
试题分析:A、对比300℃和1.01×105Pa、300℃和3.03×105Pa,压强越大,M的转化率降低,说明增大压强,化学平衡向逆反应方向移动,x+1<3,x为1,故错误;B、用不同物质的化学反应速率表示达到平衡,要求一正一逆,且反应速率之比等于化学计量数之比,v正(B)向正反应方向进行,v逆(C)向逆反应方向移动,且两者速率之比等于化学计量数之比,说明达到平衡,故正确;C、比较300℃和3.03×105Pa与500℃和3.03×105Pa,升高温度M的转化率降低,根据列夏特勒原理,此反应的正反应方向是放热反应,通入N,增加反应物的浓度,平衡向正反应方向进行,因为此反应正反应方向是放热反应,温度升高,又因为此容器是绝热容器,以及反应①是吸热反应,平衡向正反应方向移动,C的物质的量增大,故错误;D、恒容状态下,通入Q,压强增加,反应向逆反应方向进行,温度降低,反应①的反应向逆反应方向进行,化学平衡常数只受温度的影响,因此化学平衡常数减小,故错误。

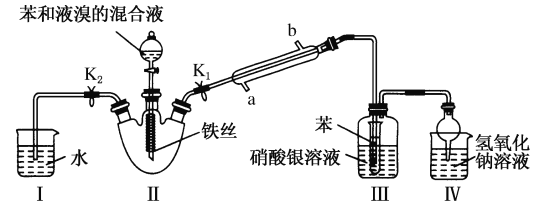
【题目】某实验小组用0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液进行中和热的测定。测定中和热的实验装置如图所示.
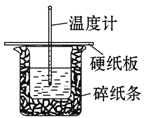
(1)大小烧杯之间填满碎泡沫塑料的作用是_________________,从实验装置上看,图中缺少的一种玻璃仪器_________________.
(2)写出该反应的用中和热表示的热化学方程式(中和热为57.3kJ/mol) 。
(3)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表
①请填写下表中的空白:
实验 次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差 (t2-t1)/℃ | 温度差平均值 (t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | ||||
1 | 26.2 | 26.0 | 26.1 | 30.1 | 4.0 | |
2 | 27.0 | 27.4 | 27.2 | 33.3 | 6.1 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | 3.9 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | 4.1 | |
②近似认为0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容C=4.18J/(g·℃)。则中和热ΔH=__________(取小数点后一位)。(已知:Q=m·c·Δt)
③上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母)__________。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
(4)实验中若用60mL0.25mol·L-1H2SO4溶液跟50mL0.55mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量__________(填“相等”、“不相等”),所求中和热__________(填“相等”、“不相等”);,若用50mL0.50mol·L-1醋酸代替H2SO4溶液进行上述实验,测得反应前后温度的变化值会__________(填“偏大”、“偏小”、“不受影响”).