题目内容
随着大气污染的日趋严重,“节能减排”,减少全球温室气体排放,研究NOx、SO2、CO等大气污染气体的处理具有重要意义
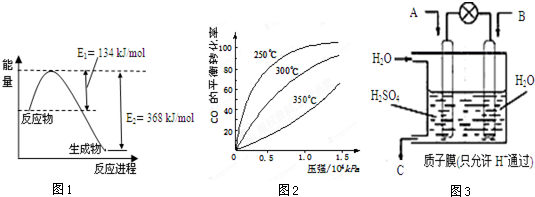
(1)如图1是1mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,写出该反应的热化学方程式:
.
已知:N2(g)+O2(g)═2NO(g)△H=+180kJ/mol
2NO (g)+O2(g)═2NO2(g)△H=-112.3kJ/mol
则反应:2NO(g)+2CO(g)=N2(g)+2CO2(g)的△H= .
(2)用活性炭还原法处理氮氧化物.有关反应为:C(s)+2NO(g)?N2(g)+CO2(g).某研究小组向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
①T1℃时,该反应的平衡常数K= (保留两位小数).
②30min后,改变某一条件,反应重新达到平衡,则改变的条件可能是 .
(3)CO可用于合成甲醇,反应方程式为:CO(g)+2H2(g)═CH3OH(g).CO在不同温度下的平衡转化率与压强的关系如图2所示.该反应△H 0(填“>”或“<”).
(4)利用Fe2+、Fe3+的催化作用,常温下将SO2转化为SO42-而实现SO2的处理(总反应为2SO2+O2+2H2O═2H2SO4).已知,含SO2的废气通入含Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2++O2+4H+═4Fe3++2H2O,则另一反应的离子方程式为 .
(5)有学者想以图3所示装置用原电池原理将SO2转化为重要的化工原料.A为SO2,B为O2,C为H2SO4,则负极反应式为 .

(1)如图1是1mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,写出该反应的热化学方程式:
已知:N2(g)+O2(g)═2NO(g)△H=+180kJ/mol
2NO (g)+O2(g)═2NO2(g)△H=-112.3kJ/mol
则反应:2NO(g)+2CO(g)=N2(g)+2CO2(g)的△H=
(2)用活性炭还原法处理氮氧化物.有关反应为:C(s)+2NO(g)?N2(g)+CO2(g).某研究小组向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
浓度/mol?L-1 时间/min | NO | N2 | CO2 |
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.040 | 0.030 | 0.030 |
| 30 | 0.040 | 0.030 | 0.030 |
| 40 | 0.032 | 0.034 | 0.017 |
| 50 | 0.032 | 0.034 | 0.017 |
②30min后,改变某一条件,反应重新达到平衡,则改变的条件可能是
(3)CO可用于合成甲醇,反应方程式为:CO(g)+2H2(g)═CH3OH(g).CO在不同温度下的平衡转化率与压强的关系如图2所示.该反应△H
(4)利用Fe2+、Fe3+的催化作用,常温下将SO2转化为SO42-而实现SO2的处理(总反应为2SO2+O2+2H2O═2H2SO4).已知,含SO2的废气通入含Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2++O2+4H+═4Fe3++2H2O,则另一反应的离子方程式为
(5)有学者想以图3所示装置用原电池原理将SO2转化为重要的化工原料.A为SO2,B为O2,C为H2SO4,则负极反应式为
考点:热化学方程式,化学电源新型电池,化学平衡的影响因素,化学平衡的计算
专题:基本概念与基本理论
分析:(1)通过图a求出 NO2(g)+CO(g)=CO2(g)+NO(g)反应的热化学方程式,然后利用盖斯定律将几个已知的热化学方程式进行运算即可求出2NO(g)+CO(g)=N2(g)+2CO2(g)的热化学方程式;
(2)①通过表中数据可知,反应进行到20-30分钟时达到平衡状态,则K=
;
②根据表中30-40分钟各物质浓度的变化可以看出改变的条件是分离出部分CO2;
(3)温度-压强-转化率图象定一议二,做一条等压线,比较不同温度下CO平衡转化率大小判断改变温度平衡移动的方向;
(4)SO2转化为SO42-该过程为氧气氧化二价铁离子到三价铁离子,然后用三价铁离子氧化二氧化硫到硫酸根;
(5)SO2-O2-H2SO4形成燃料电池,通O2的电极为正极发生还原反应,同SO2的电极为负极发生氧化反应,书写电极反应式按照先总后分的顺序,先写出总的原电池方程式,然后写出正极的电极反应式,用总方程式减去正极反应式就是负极的电极反应式;
(2)①通过表中数据可知,反应进行到20-30分钟时达到平衡状态,则K=
| c(CO2)c(N2) |
| c2(NO) |
②根据表中30-40分钟各物质浓度的变化可以看出改变的条件是分离出部分CO2;
(3)温度-压强-转化率图象定一议二,做一条等压线,比较不同温度下CO平衡转化率大小判断改变温度平衡移动的方向;
(4)SO2转化为SO42-该过程为氧气氧化二价铁离子到三价铁离子,然后用三价铁离子氧化二氧化硫到硫酸根;
(5)SO2-O2-H2SO4形成燃料电池,通O2的电极为正极发生还原反应,同SO2的电极为负极发生氧化反应,书写电极反应式按照先总后分的顺序,先写出总的原电池方程式,然后写出正极的电极反应式,用总方程式减去正极反应式就是负极的电极反应式;
解答:
解:(1)通过图a可知该反应为NO2(g)+CO(g)=CO2(g)+NO(g),该反应的焓变△H=E1-E2=134KJ/mol-368KJ/mol=-234kJ/mol 所以该反应的热化学方程式NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJ/mol①,
①NO2(g)+CO(g)=CO2(g)+NO(g)△H1=-234kJ/mol
②N2(g)+O2(g)=2NO(g)△H2=+180kJ/mol
③2NO (g)+O2(g)=2NO2(g)△H3=-112.3kJ/mol
根据盖斯定律①×2+③-②得2NO(g)+CO(g)=N2(g)+2CO2(g)△H=2×△H1+△H3-△H2=-760.3KJ/mol,
故答案为:NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234KJ/mol,-760.3KJ/mol;
(2)①当20-30分钟时反应达到平衡K=
=
=0.56,故答案为:0.56;
②根据表中30-40分钟各物质浓度的变化可以看出改变的条件是分离出部分CO2,故答案为:分离出部分CO2;
(3)当压强恒定时,温度250度升高到300度CO的平衡转化率降低,说明平衡向逆向移动,所以逆向为吸热反应,正反应为放热反应△H<0,故答案为:<;
(4)三价铁离子氧化二氧化硫到硫酸根,离子方程式为:2Fe3++SO2+2H20=2Fe2++SO42-+4H+,故答案为:2Fe3++SO2+2H20=2Fe2++SO42-+4H+;
(5)原电池总方程式为2SO2+O2+2H2O=2H2SO4,正极的电极反应式为O2+4H++4e-=2H2O,用总的减去正极的电极反应式得负极电极反应式为SO2+2H2O-2e-=SO42-+4H+,
故答案为:SO2+2H2O-2e-=SO42-+4H+;
①NO2(g)+CO(g)=CO2(g)+NO(g)△H1=-234kJ/mol
②N2(g)+O2(g)=2NO(g)△H2=+180kJ/mol
③2NO (g)+O2(g)=2NO2(g)△H3=-112.3kJ/mol
根据盖斯定律①×2+③-②得2NO(g)+CO(g)=N2(g)+2CO2(g)△H=2×△H1+△H3-△H2=-760.3KJ/mol,
故答案为:NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234KJ/mol,-760.3KJ/mol;
(2)①当20-30分钟时反应达到平衡K=
| c(CO2)c(N2) |
| c2(NO) |
| 0.03×0.03 |
| 0.042 |
②根据表中30-40分钟各物质浓度的变化可以看出改变的条件是分离出部分CO2,故答案为:分离出部分CO2;
(3)当压强恒定时,温度250度升高到300度CO的平衡转化率降低,说明平衡向逆向移动,所以逆向为吸热反应,正反应为放热反应△H<0,故答案为:<;
(4)三价铁离子氧化二氧化硫到硫酸根,离子方程式为:2Fe3++SO2+2H20=2Fe2++SO42-+4H+,故答案为:2Fe3++SO2+2H20=2Fe2++SO42-+4H+;
(5)原电池总方程式为2SO2+O2+2H2O=2H2SO4,正极的电极反应式为O2+4H++4e-=2H2O,用总的减去正极的电极反应式得负极电极反应式为SO2+2H2O-2e-=SO42-+4H+,
故答案为:SO2+2H2O-2e-=SO42-+4H+;
点评:本题考查了盖斯定律求反应热、化学平衡常数及化学平衡移动的影响因素、原电池电极反应式的书写、氧化还原反应、溶度积规则等,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列离子方程式正确的是( )
| A、铜片浸入到稀盐酸中Cu+2H+═Cu2++H2↑ |
| B、二氧化硅浸泡在氢氧化钠溶液中SiO2+2OH-═SiO32-+H2O |
| C、铁片插入硝酸银溶液中Fe+Ag+═Fe2++Ag |
| D、向碳酸钡粉末中滴入稀硫酸CO32-+2H+═H2O+CO2↑ |
下列各溶液中,相关微粒物质的量浓度关系不正确的是( )
| A、0.1mol?L-1 NaHCO3溶液中:c(OH-)=c(H+)+c(H2CO3)-c(CO32-) |
| B、0.1mol?L-1 NH4Cl溶液中:c(Cl-)=c(NH4+)+c(NH3?H2O)=0.1mol?L-1 |
| C、pH=2的HA溶液与pH=12的MOH溶液任意比混合:c(H+)+c(M+)=c(OH-)+c(A-) |
| D、常温下,浓度为0.1mol?L-1 NaHSO3溶液的pH<7:c(Na+)>c(HSO3-)>c(SO32-)>c(H+) |
下列关于硝酸的叙述正确的是( )
| A、稀硝酸是弱酸,浓硝酸是强酸 |
| B、铜与稀硝酸和浓硝酸都能生成二氧化氮 |
| C、稀硝酸和浓硝酸都是强氧化剂 |
 常温下,A是双原子分子气态单质,其密度为3.17g/L(标准状况下),B、C、D都是含A元素的化合物,转化关系如图所示
常温下,A是双原子分子气态单质,其密度为3.17g/L(标准状况下),B、C、D都是含A元素的化合物,转化关系如图所示