题目内容
下列离子方程式正确的是( )
| A、铜片浸入到稀盐酸中Cu+2H+═Cu2++H2↑ |
| B、二氧化硅浸泡在氢氧化钠溶液中SiO2+2OH-═SiO32-+H2O |
| C、铁片插入硝酸银溶液中Fe+Ag+═Fe2++Ag |
| D、向碳酸钡粉末中滴入稀硫酸CO32-+2H+═H2O+CO2↑ |
考点:离子方程式的书写
专题:离子反应专题
分析:A.Cu与稀盐酸不反应;
B.反应生成硅酸钠和水;
C.电子、电荷不守恒;
D.碳酸钡、硫酸钡在离子反应中保留化学式,反应生成硫酸钡、水和二氧化碳.
B.反应生成硅酸钠和水;
C.电子、电荷不守恒;
D.碳酸钡、硫酸钡在离子反应中保留化学式,反应生成硫酸钡、水和二氧化碳.
解答:
解:A.Cu与稀盐酸不反应,则不能写离子反应,故A错误;
B.反应生成硅酸钠和水,离子反应为SiO2+2OH-═SiO32-+H2O,故B正确;
C.铁片插入硝酸银溶液中的离子反应为Fe+2Ag+═Fe2++2Ag,故C错误;
D.向碳酸钡粉末中滴入稀硫酸的离子反应为BaCO3+SO42-+2H+═H2O+CO2↑+BaSO4,故D错误;
故选B.
B.反应生成硅酸钠和水,离子反应为SiO2+2OH-═SiO32-+H2O,故B正确;
C.铁片插入硝酸银溶液中的离子反应为Fe+2Ag+═Fe2++2Ag,故C错误;
D.向碳酸钡粉末中滴入稀硫酸的离子反应为BaCO3+SO42-+2H+═H2O+CO2↑+BaSO4,故D错误;
故选B.
点评:本题考查离子反应的书写,为高频考点,把握发生的化学反应及离子反应中保留化学式的物质为解答的关键,注意选项D为解答的易错点,题目难度不大.

练习册系列答案
 教材全解字词句篇系列答案
教材全解字词句篇系列答案
相关题目
将金属钠投入AlCl3溶液中,下列有关叙述一定正确的是( )
| A、有气体生成,最后一定有白色沉淀 |
| B、一定无气体生成 |
| C、溶液最后澄清且有气体放出 |
| D、一定有气体生成 |
下列元素中,属于非金属元素的是( )
| A、Ca | B、C | C、Na | D、Al |
下列说法中正确的是( )
| A、硫酸的摩尔质量是98g |
| B、摩尔是物质质量的单位 |
| C、氮原子的质量就是氮的相对原子质量 |
| D、氧气的摩尔质量(单位:g?mol-1)在数值上等于它的相对分子质量 |
根据电子排布的特点,Cu在周期表属于( )
| A、s区 | B、p区 | C、d区 | D、ds区 |
下列有关概念说法正确的是( )
| A、D2、T2、H2互为同素异形体 |
| B、甲烷和异丁烷互为同系物 |
| C、石墨、金刚石互为同位素 |
| D、乙烷和乙烯互为同分异构体 |
化学与环境、材料、能源关系密切,下列说法错误的是( )
| A、水泥冶金厂常用高压电除去工厂烟尘,利用了胶体的性质 |
| B、煤的气化和煤的液化都可以使煤变为清洁能源,煤的气化和煤的液化都属于物理变化 |
| C、我国首艘航母“辽宁舰”上用于舰载机降落的拦阻索是特种钢缆,属于金属材料 |
| D、页岩气是从页岩层中开采出来的天然气.由于产气的页岩分布广、厚度大,且普遍含气,故可以成为新的化石燃料来源 |
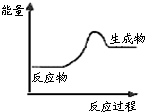 根据如图提供的信息,下列所得结论不正确的是( )
根据如图提供的信息,下列所得结论不正确的是( )| A、该反应为放热反应 |
| B、该反应一定有能量转化成了化学能 |
| C、反应物比生成物稳定 |
| D、因为生成物的总能量高于反应物的总能量,所以该反应不需要加热 |