题目内容
【题目】(1)碳的一种单质的结构如图(a)所示。该单质的晶体类型为___________,碳原子的杂化轨道类型为_________。


(2)SiCl4分子的中心原子的价层电子对数为__________,分子的立体构型为_______。
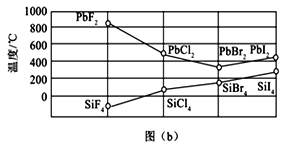
(3)四卤化硅SiX4的沸点和二卤化铅PbX2的熔点如图(b)所示。
SiX4的沸点依F、Cl、Br、I次序升高的原因是:______________________________________。
(4)碳的另一种单质C60可以与钾形成低温超导化合物,晶体结构如图(c)所示。K位于立方体的棱上和立方体的内部,此化合物的化学式为_______________;其晶胞参数为1.4 nm,晶体密度为___________________________________g·cm-3(列式并计算保留1位小数)。
【答案】混合型晶体 sp2 4 正四面体 均为分子晶体,范德华力随分子相对质量增大而增大 K3C60 2.0
【解析】
(1)碳的一种单质的结构如图(a)所示,应为石墨;同层的碳原子与相邻碳原子形成3个![]() 键,无孤电子对;(2)中心原子的价层电子对数=中心原子孤电子对数+中心原子与周围原子形成σ键电子对数;(3)SiX4均为分子晶体,相对分子质量越大,沸点越高;(4)根据均摊原则计算化学式;1个晶胞含有4个C60、12个K原子,所以晶胞的摩尔质量是4×60×12+12×39=3348g/mol;晶胞参数1.4nm,则1个晶胞的体积是(1.4×10-7)3cm3。
键,无孤电子对;(2)中心原子的价层电子对数=中心原子孤电子对数+中心原子与周围原子形成σ键电子对数;(3)SiX4均为分子晶体,相对分子质量越大,沸点越高;(4)根据均摊原则计算化学式;1个晶胞含有4个C60、12个K原子,所以晶胞的摩尔质量是4×60×12+12×39=3348g/mol;晶胞参数1.4nm,则1个晶胞的体积是(1.4×10-7)3cm3。
(1)碳的一种单质的结构如图(a)所示,应为石墨,属于混合型晶体;同层的碳原子与相邻碳原子形成3个![]() 键,无孤电子对,所以碳原子的杂化轨道类型为sp2;(2)中心原子的价层电子对数=中心原子孤电子对数+中心原子与周围原子形成σ键电子对数,SiCl4分子的中心原子是Si,孤电子对数为0,与氯原子形成4个σ键,所以价层电子对数为4;根据价电子互斥理论,SiCl4分子的立体构型为正四面体;(3)SiX4均为分子晶体,范德华力随分子相对质量增大而增大,所以SiX4的沸点依F、Cl、Br、I次序升高;(4)根据均摊原则,1个晶胞中C60数是
键,无孤电子对,所以碳原子的杂化轨道类型为sp2;(2)中心原子的价层电子对数=中心原子孤电子对数+中心原子与周围原子形成σ键电子对数,SiCl4分子的中心原子是Si,孤电子对数为0,与氯原子形成4个σ键,所以价层电子对数为4;根据价电子互斥理论,SiCl4分子的立体构型为正四面体;(3)SiX4均为分子晶体,范德华力随分子相对质量增大而增大,所以SiX4的沸点依F、Cl、Br、I次序升高;(4)根据均摊原则,1个晶胞中C60数是![]() ,K原子数是
,K原子数是![]() ,所以化学式为K3C60;1个晶胞含有4个C60、12个K原子,所以晶胞的摩尔质量是4×60×12+12×39=3348g/mol;晶胞参数1.4nm,则1个晶胞的体积是(1.4×10-7)3cm3,晶体的密度为
,所以化学式为K3C60;1个晶胞含有4个C60、12个K原子,所以晶胞的摩尔质量是4×60×12+12×39=3348g/mol;晶胞参数1.4nm,则1个晶胞的体积是(1.4×10-7)3cm3,晶体的密度为![]() g·cm–3=2.0 g·cm–3。
g·cm–3=2.0 g·cm–3。

 阅读快车系列答案
阅读快车系列答案

