题目内容
【题目】某研究性学习小组欲测定室温下(25℃、101kPa)的气体摩尔体积,请回答下列问题。该小组设计的简单实验装置如图所示,该实验的主要操作步骤如下:
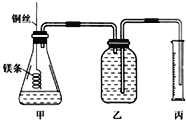
配制100ml1.0mol·L-1的盐酸溶液,用______(填仪器名称并注明规格)量取10.0ml1.0mol/L的盐酸溶液加入锥形瓶中;用托盘天平称取ag已除去表面氧化膜的镁条,并系于铜丝末端,为使HCl全部参加反应,a的数值至少为_________;往广口瓶中装入足量水,按如图连接好装置,检查装置的气密性;反应结束后待体系温度恢复到室温,读出量筒中水的体积为VmL。
(1)请将上述步骤补充完整。
(2)用文字表述实验步骤④中检查装置气密性的方法:__________________________。
(3)实验步骤⑤中应选用_________(填序号)的量筒。
A.100ml B.200ml C.500ml
(4)若忽略水蒸气的影响,在实验条件下测得气体摩尔体积Vm=_____________,若未除去镁条表面的氧化膜,则测量结果___________________(填“偏大”、“偏小”或“无影响”)。
(5)若在配制盐酸过程中出现下列情况,将使所配制的溶液的浓度偏高的是___________(填各选项的序号)。
a.配制溶液所用的容量瓶洗净后没有烘干
b.转移溶液后,未洗涤烧杯和玻璃棒就直接定容
c.最后确定HCl溶液体积(定容)时,俯视观察液面与容量瓶刻度线
d.定容摇匀后静置,发现液面低于刻度线,再加蒸馏水至刻度线
【答案】10ml量筒 0.12 两手掌紧贴锥形瓶外壁一会儿,如果观察到广口瓶中长导管内有一段水柱高出液面,表明装置气密性良好 B 0.2VL/mol 偏小 c
【解析】
量取溶液的最小读数为0.1mL,可以用10mL量筒量取;根据n=cV计算出盐酸中含有HCl的物质的量,再根据反应生成氯化镁计算出消耗镁的物质的量,最后根据m=nM计算出最小质量;两手掌紧贴锥形瓶外壁,根据广口瓶中长导管内是否有一段水柱高出液面判断装置气密性;读数时要保持左右气体压强相等,以减少误差,故应将量筒缓缓向下移动,使乙、丙中液面相平;若未除去镁条表面的氧化膜,导致镁的质量偏小,生成气体体积偏小。
(1)②量取10.0mL1.0molL-1的盐酸,需要用10mL量筒量取;③10.0mL1.0molL-1的盐酸溶液中含有HCl的物质的量为:1.0mol/L×0.01L=0.01mol,根据反应Mg+2HCl═MgCl2+H2↑可知最少消耗Mg的物质的量为0.005mol,质量为:24g/mol×0.005mol=0.12g,则a至少为0.12。(2)检查装置气密性的方法为:两手掌紧贴锥形瓶外壁一会儿,如果观察到广口瓶中长导管内有一段水柱高出液面,表明装置气密性良好。(3)10.0mL1.0molL-1的盐酸溶液中含有HCl的物质的量为0.01mol,根据根据反应Mg+2HCl═MgCl2+H2↑可知生成氢气的物质的量为0.005mol,标准状况下0.005mol氢气的体积为:22.4L/mol×0.05mol=112mL,应该用200mL量筒。(4)实验测得,0.005mol氢气的体积为VmL,则气体摩尔体积Vm=0.001VL/0.005mol=0.2VL/mol;若未除去镁条表面的氧化膜,生成的氢气体积减少,导致测量的气体摩尔体积偏低。(5)配制最后需加水定容,容量瓶洗净后没有烘干,对所配溶液浓度无影响;未用蒸馏水洗涤烧杯和玻璃棒,溶质的物质的量减少,所配溶液浓度偏低;定容时俯视容量瓶刻度线,所配溶液体积偏小,导致所配溶液浓度偏高;反复倒转摇匀后,液面低于刻度线,此时有少量溶液残留在玻璃塞和瓶口之间,浓度不变,属于正常现象,但又补充了水,所配溶液体积偏大,导致所配溶液浓度偏小,故选C。

 53随堂测系列答案
53随堂测系列答案【题目】已知:H2(g)+Br2(l)=2HBr(g) H=-akJ/mol,蒸发1molBr2(l)需要吸收的能量为30kJ,其他数据如下表:
H2(g) | Br2(g) | HBr(g) | |
1mol分子中的化学键断裂时需要吸收的能量/kJ | 436 | b | 369 |
下列说法正确的是
A. 2HBr(g)=H2(g)+Br2(g)H=+akJ/mol
B. H2(g)的稳定性低于HBr(g)
C. Br2(g)=Br2(l) H=+30kJ/mol
D. b=272-a