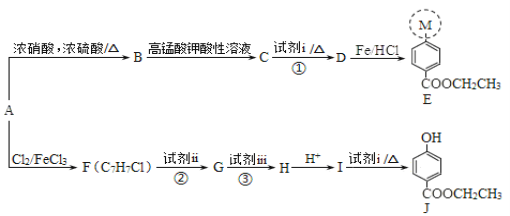
题目内容
【题目】以铬铁矿[Fe(CrO2)2]为原料可制备K2Cr2O7和金属铬。实验流程如下:
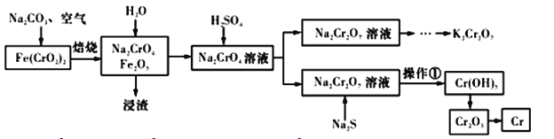
已知:2CrO42-+2H+=Cr2O72-+H2O。pH<3.0,CrO42-含量极小。
(1)写出铬铁矿焙烧转化为Na2CrO4的化学反应方程式:_____________________________________;焙烧时不能使用陶瓷容器的原因是________________________________________。
(2)加入稀硫酸后所得Na2Cr2O7溶液的pH应小于3.0,可用_________________测定溶液pH。
(3)操作①包括过滤和洗涤。实验室洗涤沉淀的操作是________________________________。
(4)Na2S的作用是①__________________________和②___________________________。
(5)Fe3+在pH为3.7时可完全转化为Fe(OH)3。在上述流程中所得Na2Cr2O7溶液中含有少量Fe3+。请结合下图有关物质的溶解度曲线,设计由Na2Cr2O7溶液制备K2Cr2O7固体的实验方案(实验中须选用的试剂:硫酸溶液、NaOH溶液、KCl固体、蒸馏水)____________________。

【答案】4Fe(CrO2)2+7O2+8Na2CO3![]() 2Fe2O3+8Na2CrO4+8CO2 陶瓷在高温下会与Na2CO3反应 pH计 沿玻璃棒加水至浸设沉淀,待水自然滤出后重复2~3次 调节溶液的酸碱度 将重铬酸钠还原为氢氧化铬 ①向Na2Cr2O7溶液中加入适量NaOH溶液调节pH大于3.7,过滤;②向①中滤液加入硫酸溶液至pH小于3.0,再加入适量KCl固体,蒸发浓缩,冷却结晶,过滤,洗涤,干燥
2Fe2O3+8Na2CrO4+8CO2 陶瓷在高温下会与Na2CO3反应 pH计 沿玻璃棒加水至浸设沉淀,待水自然滤出后重复2~3次 调节溶液的酸碱度 将重铬酸钠还原为氢氧化铬 ①向Na2Cr2O7溶液中加入适量NaOH溶液调节pH大于3.7,过滤;②向①中滤液加入硫酸溶液至pH小于3.0,再加入适量KCl固体,蒸发浓缩,冷却结晶,过滤,洗涤,干燥
【解析】
根据流程图可知,煅烧过程中,铬铁矿转化生成得到Na2CrO4、Fe2O3和CO2;溶解过滤得到含有杂质的Na2CrO4浸出液,调节溶液pH,过滤除去不溶性的物质,得到Na2CrO4溶液;向溶液中加入稀硫酸使CrO42-转化为Cr2O72--,得到Na2Cr2O7溶液;向Na2Cr2O7溶液中加入Na2S,Na2S调节溶液的酸碱度的同时将重铬酸钠还原为氢氧化铬;过滤、洗涤得到氢氧化铬沉淀,氢氧化铬受热分解得到氧化铬,氧化铬还原得到铬单质;向Na2Cr2O7溶液中加入KCl固体,经蒸发浓缩、冷却结晶、过滤、洗涤、干燥得到K2Cr2O7。
(1)根据流程图可知,高温煅烧过程中,铬铁矿与纯碱、空气中氧气反应,转化生成Na2CrO4、Fe2O3和CO2,反应的化学方程式为4Fe(CrO2)2+7O2+8Na2CO3![]() 2Fe2O3+8Na2CrO4
2Fe2O3+8Na2CrO4
+8CO2;因陶瓷中含有二氧化硅,二氧化硅在高温下会与Na2CO3反应生成硅酸钠和二氧化碳。(2)要检测酸化操作中溶液的pH是否等于3.0,普通pH试纸只能测定溶液pH到整数,是近似测定,准确测定需要用pH计。而且该溶液是有色的强氧化剂,故不适宜用pH试纸测定其pH值。(3)实验室洗涤沉淀在过滤器中完成,洗涤沉淀的操作是沿玻璃棒向过滤器中加蒸馏水至浸没沉淀,待水自然滤出后,重复操作2~3次。(4)向Na2Cr2O7溶液中加入Na2S,由于其有还原性、且其水解可以使溶液显碱性,故Na2S的作用是调节溶液的酸碱度、将重铬酸钠还原为氢氧化铬。(5)由Na2Cr2O7溶液制备K2Cr2O7固体的实验方案是先调节溶液pH,在pH为3.7时将Fe3+完全转化为Fe(OH)3沉淀,过滤,向滤液中加入硫酸溶液至pH小于3.0,以减少铬酸根离子;依据题给溶解度曲线可知,重铬酸钾的溶解度随温度变化较大,故向除杂后的溶液中加入KCl固体,经蒸发浓缩、冷却结晶、过滤、洗涤、干燥等操作,通过复分解反应将Na2Cr2O7转化为溶解度更小的K2Cr2O7晶体。