题目内容
12. X、Y、Z、R为前四周期元素,原子序数依次增大.X、Y同周期,X基态原子的最外层电子数是次外层的2倍,Y基态原子的s能级和p能级上电子数相等;Z是地壳中含量最高的金属元素; R+离子的3d轨道全充满.请回答下列问题:
X、Y、Z、R为前四周期元素,原子序数依次增大.X、Y同周期,X基态原子的最外层电子数是次外层的2倍,Y基态原子的s能级和p能级上电子数相等;Z是地壳中含量最高的金属元素; R+离子的3d轨道全充满.请回答下列问题:(1)Z3+离子的核外电子排布式是1s22s22p6.
(2)科学家成功地在高压下将 XY2转化为具有类似SiO2 结构的原子晶体,该晶体中X原予的杂化轨道类型是sp3:X、Z、R的单质分别与足量Y2 充分反应所得产物的熔点由高到低的顺序是Al2O3>CuO>CO2.(填化学式)
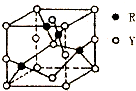
(3)由Y、R形成的某化合物的晶胞结构如右图所示,其化学式是CuO.
(4)已知Y元素与 R+形成的二元化合物在稀硫酸溶液中不稳定,写出该反应的离子方程式Cu2O+2H+=Cu+Cu2++H2O.
(5)常温下,pH相同的NaZY2 与Na2XY3 两种溶液,物质的量浓度较大的是Na2CO3.(填化学式)
(6)将亚硫酸钠的水溶液逐滴加入 RCl2的水溶液中,再加入少量浓盐酸混匀,得到难溶的白色沉淀RC1,该反应的离子方程式是SO32-+2Cu2++2Cl-+H2O=2CuCl↓+SO42-+2H+.
分析 X、Y、Z、R为前四周期元素,原子序数依次增大,X、Y同周期,X基态原子的最外层电子数是次外层的2倍,其次外层电子数是2,则X是C元素,Y基态原子的s能级和p能级上电子数相等,则Y是O元素;Z是地壳中含量最高的金属元素,为Al元素; R+离子的3d轨道全充满,则R是Cu元素;
(1)Z是Al元素,Al失去3个电子生成铝离子,根据构造原理书写铝离子核外电子排布式;
(2)该二氧化碳为原子晶体,每个C原子和4个Si原子形成4个共价键,为sp3杂化;
X、Z、R的单质分别与足量Y2 充分反应所得产物分别是二氧化碳、氧化铝和CuO,氧化铝是原子晶体、CuO是离子晶体、二氧化碳是分子晶体,熔沸点高低顺序是:原子晶体>离子晶体>分子晶体;
(3)该晶胞中Cu离子个数=4,氧离子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,据此确定化学式;
(4)氧化亚铜和酸反应生成铜离子、Cu和水;
(5)常温下,pH相同的NaAlO2 与Na2CO3 两种溶液,酸根离子水解程度越大,钠盐溶液浓度越小;
(6)盐酸、亚硫酸根离子和铜离子发生氧化还原反应生成CuCl白色沉淀、硫酸根离子.
解答 解:X、Y、Z、R为前四周期元素,原子序数依次增大,X、Y同周期,X基态原子的最外层电子数是次外层的2倍,其次外层电子数是2,则X是C元素,Y基态原子的s能级和p能级上电子数相等,则Y是O元素;Z是地壳中含量最高的金属元素,为Al元素; R+离子的3d轨道全充满,则R是Cu元素;
(1)Z是Al元素,Al失去3个电子生成铝离子,根据构造原理书写铝离子核外电子排布式为1s22s22p6,
故答案为:1s22s22p6;
(2)该二氧化碳为原子晶体,每个C原子和4个Si原子形成4个共价键,为sp3杂化;
X、Z、R的单质分别与足量Y2 充分反应所得产物分别是二氧化碳、氧化铝和CuO,氧化铝是原子晶体、CuO是离子晶体、二氧化碳是分子晶体,熔沸点高低顺序是:原子晶体>离子晶体>分子晶体,所以晶体熔沸点高低顺序是Al2O3>CuO>CO2,
故答案为:sp3;Al2O3>CuO>CO2;
(3)该晶胞中Cu离子个数=4,氧离子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,铜离子和氧离子个数之比=4:4=1:1,其化学式为CuO,故答案为:CuO;
(4)氧化亚铜和酸反应生成铜离子、Cu和水,离子方程式为Cu2O+2H+=Cu+Cu2++H2O,故答案为:Cu2O+2H+=Cu+Cu2++H2O;
(5)常温下,pH相同的NaAlO2 与Na2CO3 两种溶液,酸根离子水解程度越大,钠盐溶液浓度越小,偏铝酸根离子水解程度大于碳酸根离子,所以pH相同时碳酸钠浓度较大,故答案为:Na2CO3;
(6)盐酸、亚硫酸根离子和铜离子发生氧化还原反应生成CuCl白色沉淀、硫酸根离子,离子方程式为SO32-+2Cu2++2Cl-+H2O=2CuCl↓+SO42-+2H+,
故答案为:SO32-+2Cu2++2Cl-+H2O=2CuCl↓+SO42-+2H+.
点评 本题考查位置结构性质相互关系及应用,为高频考点,涉及晶胞计算、氧化还原反应、离子方程式的书写、原子杂化等知识点,侧重考查基本理论、基本计算,注意酸性条件下氧化亚铜自身发生氧化还原反应,题目难度不大.

 高中必刷题系列答案
高中必刷题系列答案| A. | 0.1mol•L-1的Na2S溶液中,S2-的数目小于0.1NA | |
| B. | 0.1mol丙烷中含有的共价键数目为0.8NA | |
| C. | 标准状况下,11.2L甲醇中含有的分子数目为0.5NA | |
| D. | 0.1mol氧化钠和过氧化钠的混合物中含有的离子总数为0.3NA |
| A. | SiO2既可与NaOH溶液反应也可与HF溶液反应,所以SiO2属于两性氧化物 | |
| B. | SO2溶于水后,其水溶液可以导电,所以SO2属于电解质 | |
| C. | 当光束照射云、烟、雾时,均可看到明显的光路,是因为三者都属于胶体 | |
| D. | 14CO2和12CO2具有相同的元素组成,所以14CO2、12CO2属于同素异形体 |
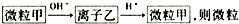 ,则甲是( )
,则甲是( )| A. | Fe2+ | B. | Mg2+ | C. | Al | D. | CO2 |
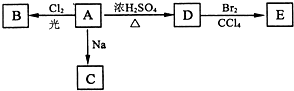
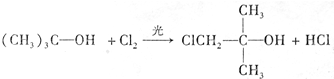 ;A转化为D的反应的类型消去反应.
;A转化为D的反应的类型消去反应.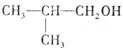 .
.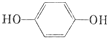 .
.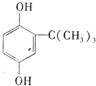 .
.

 ;
;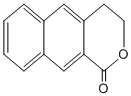 是一种重要的药物合成中间体,请结合题目所给信息,
是一种重要的药物合成中间体,请结合题目所给信息,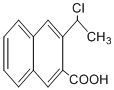 为原料制备该化合物的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
为原料制备该化合物的合成路线流程图(无机试剂任用).合成路线流程图示例如下: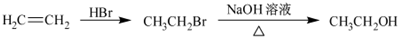
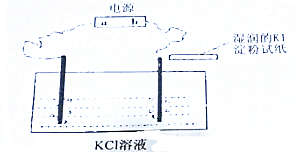

 +H2O$→_{△}^{H+}$
+H2O$→_{△}^{H+}$ +CH3CH2OH.M与新制氢氧化铜悬浊液反应的化学方程式CH3CHO+2Cu(OH)2$\stackrel{△}{→}$CH3COOH+Cu2O↓+2H2O
+CH3CH2OH.M与新制氢氧化铜悬浊液反应的化学方程式CH3CHO+2Cu(OH)2$\stackrel{△}{→}$CH3COOH+Cu2O↓+2H2O 、
、 、
、 、
、 、
、 .
.