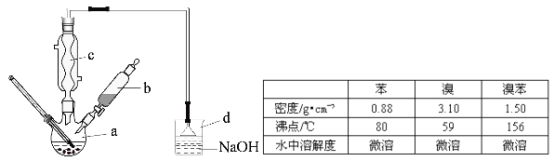
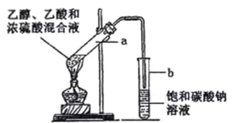
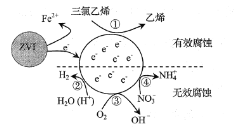
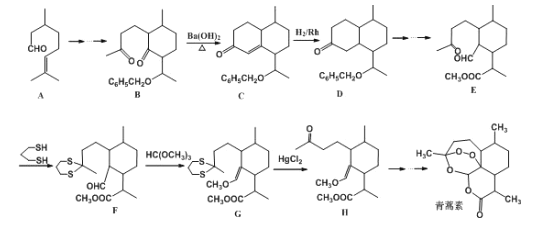
题目内容
【题目】25℃时,HCN溶液中CN-和HCN浓度所占分数(α)随pH变化的关系如图所示,下列表述正确的是( )
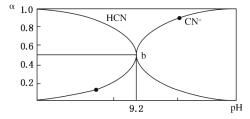
A.Ka(HCN)的数量级为10-9
B.0.1mol/LHCN溶液使甲基橙试液显红色
C.1L物质的量都是0.1mol的HCN和NaCN混合溶液中c(HCN)>c(CN-)
D.0.1mol/LNaCN溶液的pH=9.2
【答案】C
【解析】
A.电离平衡常数只受温度的影响,与浓度无关,取b点,c(HCN)=c(CN-),则有HCN的电离平衡常数表达式为Ka=![]() =c(H+)=10-9.2,Ka(HCN)的数量级约为10-10,故A错误;
=c(H+)=10-9.2,Ka(HCN)的数量级约为10-10,故A错误;
B. HCN为弱酸,其电离方程式为HCN![]() H++CN-,弱电解质的电离程度微弱,可以认为c(H+)=c(CN-),c(HCN)=0.1mol·L-1,根据电离平衡常数,0.1mol·L-1HCN溶液:
H++CN-,弱电解质的电离程度微弱,可以认为c(H+)=c(CN-),c(HCN)=0.1mol·L-1,根据电离平衡常数,0.1mol·L-1HCN溶液:![]() =10-10,解得c(H+)=10-5.5,即pH=5.5,甲基橙:当pH<3.1时变红,因此0.1mol·L-1HCN溶液不能使甲基橙显红色,故B错误;
=10-10,解得c(H+)=10-5.5,即pH=5.5,甲基橙:当pH<3.1时变红,因此0.1mol·L-1HCN溶液不能使甲基橙显红色,故B错误;
C. CN-水解平衡常数Kh=![]() =10-4>Ka=10-10,即CN-的水解大于HCN的电离,从而推出1L物质的量都是0.1mol的HCN和NaCN混合溶液中:c(CN-)<c(HCN),故C正确;
=10-4>Ka=10-10,即CN-的水解大于HCN的电离,从而推出1L物质的量都是0.1mol的HCN和NaCN混合溶液中:c(CN-)<c(HCN),故C正确;
D. 根据CN-水解平衡常数,得出:![]() =10-4,c(OH-)=10-2.5,pOH=2.5,则pH=11.5,故D错误;
=10-4,c(OH-)=10-2.5,pOH=2.5,则pH=11.5,故D错误;
答案:C。

 智慧小复习系列答案
智慧小复习系列答案【题目】下列实验可以达到目的或得出结论的是( )
选项 | 实验目的或结论 | 实验过程 |
A | 探究浓硫酸的脱水性 | 向表面皿中加入少量胆矾,再加入约3mL浓硫酸,搅拌,观察实验现象 |
B | 相同温度下,Ksp(ZnS)<Ksp(CuS) | 向2mL ZnSO4 和CuSO4的混合溶液中逐滴加入0.01mol/L Na2S溶液,先出现白色沉淀 |
C | 淀粉已经完全水解 | 取少量酸催化后的淀粉水解液于试管中,先加入过量氢氧化钠溶液中和酸,再加少量碘水,溶液未变蓝 |
D |
| 向NaAlO2的试管中滴加碳酸氢钠溶液,产生白色沉淀 |
A.AB.BC.CD.D
【题目】元素周期表是学习化学的重要工具,它隐含着许多信息和规律。如图是元素周期表的一部分,表中所列序号①、②、③、④、⑤、⑥、⑦、⑧分别代表某种化学元素。根据表格所给信息,回答下列问题:
族 周期 | ⅠA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ||||||
3 | ⑤ | ⑥ | ⑦ | ④ | ⑧ | |||
(1)8种元素中,性质最稳定的是___(填元素符号)。
(2)①与④可形成___化合物(填“共价”、“离子”),其电子式为___。
(3)原子半径②___③,①___⑤(填“>”、“<”或“=”)。
(4)在元素⑤、⑥、⑦中,金属性最强的元素是___。(填元素符号)。