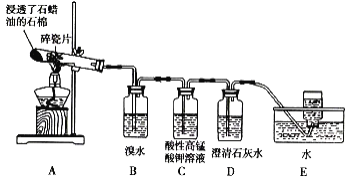
题目内容
【题目】元素周期表是学习化学的重要工具,它隐含着许多信息和规律。如图是元素周期表的一部分,表中所列序号①、②、③、④、⑤、⑥、⑦、⑧分别代表某种化学元素。根据表格所给信息,回答下列问题:
族 周期 | ⅠA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ||||||
3 | ⑤ | ⑥ | ⑦ | ④ | ⑧ | |||
(1)8种元素中,性质最稳定的是___(填元素符号)。
(2)①与④可形成___化合物(填“共价”、“离子”),其电子式为___。
(3)原子半径②___③,①___⑤(填“>”、“<”或“=”)。
(4)在元素⑤、⑥、⑦中,金属性最强的元素是___。(填元素符号)。
【答案】Ar 共价 ![]() > < Na
> < Na
【解析】
依据元素在周期表中的位置,可确定①为H,②为C,③为O,④为Cl,⑤为Na,⑥为Mg,⑦为Al,⑧为Ar。
(1)8种元素中,原子最外层达到稳定结构时,性质最稳定,所以性质最稳定的元素是Ar。答案为:Ar;
(2) ①为H,④为Cl,①与④可形成HCl,两种非金属原子间形成共价键,为共价化合物,其电子式为![]() 。答案为:共价;
。答案为:共价;![]() ;
;
(3)②为C,③为O,二者为同周期元素,O在C的右边,所以原子半径C>O;①为H,⑤为Na,Na与H同主族,且Na比H多了2个电子层,所以原子半径H<Na。答案为:>;<;
(4) ⑤为Na,⑥为Mg,⑦为Al,三种金属为同周期元素,从左往右,金属性依次减弱,所以金属性最强的元素是Na。答案为:Na。

练习册系列答案
 金钥匙试卷系列答案
金钥匙试卷系列答案
相关题目