��Ŀ����
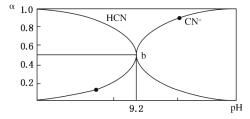
����Ŀ������С�����������ZVI���ĵ绯ѧ��ʴ����������ϩ������ˮ�����Ĺ�����ͼ��ʾ��H+��O2��NO3���ȹ�����Ĵ��ڻ�Ӱ��ˮ����Ч�������嵥λʱ����ZVI�ͷŵ��ӵ����ʵ���Ϊnt������������Ч��ʴ�ĵ��ӵ����ʵ���Ϊne������˵��������ǣ� ��
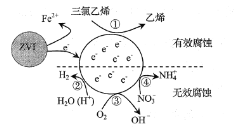
A. ��Ӧ�٢ڢۢ�������������
B. ��λʱ���ڣ�������ϩ��ȥamolClʱne=amol
C. ���ĵ缫��ӦʽΪNO3��+10H++8e��=NH4++3H2O
D. ����λ���ˮ����С����ZVI��Ͷ��������ʹnt����
���𰸡�B
��������
Aѡ���������ʾ��ͼ�з�Ӧǰ��Ԫ�ػ��ϼ۱仯��֪����Ӧ�٢ڢܾۢ�Ϊ�õ��ӵķ�Ӧ������Ӧ��������������A��ȷ��
Bѡ�������ϩC2HCl3��Cԭ�ӻ��ϼ�Ϊ+1�ۣ���ϩ��Cԭ�ӻ��ϼ�Ϊ-2�ۣ�1 mol C2HCl3ת��Ϊ1 molC2H4ʱ���õ�6 mol���ӣ���ȥ3 mol��ԭ�ӣ�������ȥa mol Clʱne = 2a mol����B����
Cѡ���ʾ��ͼ��NԪ�صĻ��ϼ۱仯��д������ת��NO3_ + 8e_ �� NH4+����������������NH4+����ֻ����H+��H2O����ƽ�÷�Ӧ����������H2O��OH_����ƽ������ �ܵĵ缫��ӦʽΪNO3_ + 10H+ + 8e_ = NH4+ + 3H2O����C��ȷ��
Dѡ�����λ���ˮ����С��ZVI��Ͷ��������������С��ZVI�������ĽӴ�������ӿ�ZVI�ͷŵ��ӵ����ʣ���ʹnt����D��ȷ��
������������ΪB��