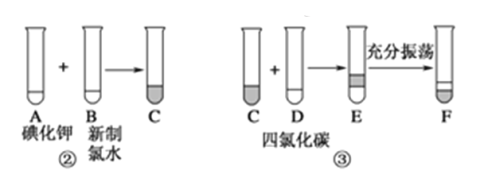
题目内容
【题目】工业生产需要大量原料,消耗大量能源,在得到所需产品同时产生了大量废气、废水、废渣。某工厂排放的废水中含有Cu2+、Fe2+、Hg2+、H+等离子,某化学小组为了充分利用资源和保护环境,准备回收废水中的铜和汞,同时得到绿矾。他们设计了如下实验方案:
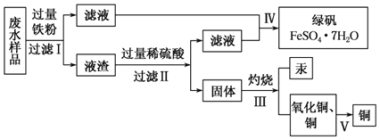
(1)步骤Ⅰ中加入过量铁粉的目的是_______________________________。
(2)步骤Ⅱ中________(填“能”或“不能”),用盐酸代替硫酸,写出步骤Ⅱ中涉及反应的化学方程式:____________________________________。
(3)步骤Ⅳ得到绿矾的操作蒸发浓缩______________、______________、洗涤、干燥。现有仪器:酒精灯、玻璃棒、坩埚、蒸发皿、蒸馏烧瓶、烧杯、铁架台等,完成步骤Ⅳ的实验操作还需要选择的玻璃仪器是___________。
(4)步骤 V利用氧化铜制取铜有如下四种方案:
方案甲:利用氢气还原氧化铜;方案乙:利用一氧化碳还原氧化铜;
方案丙:利用炭粉还原氧化铜;
方案丁:先将氧化铜溶于稀硫酸,然后加入过量的铁粉、过滤,再将滤渣溶于过量的稀硫酸,再过滤、洗涤、烘干。从安全角度考虑,方案_________不好;从产品纯度考虑,方案_________不好。
【答案】将Cu2+、Hg2+部置换出来 不能 Fe+H2SO4=FeSO4+H2↑ 冷却结晶 过滤 漏斗 甲、乙 丙
【解析】
(1)加入过量的铁粉,可以将Cu2+、Hg2+全部转化为单质置换出来;
(2)步骤Ⅱ中不能用盐酸代替硫酸,若用稀盐酸代替稀硫酸,制得的绿矾中会混有氯化亚铁,步骤Ⅱ中稀硫酸与铁反应生成硫酸亚铁和氢气,涉及反应的化学方程式为:Fe+H2SO4=FeSO4+H2↑;
(3)步骤Ⅳ得到绿矾的操作蒸发浓缩、冷却结晶、过滤、洗涤、干燥。完成步骤Ⅳ的实验操作需要的仪器有:酒精灯、玻璃棒、坩埚、蒸发皿、蒸馏烧瓶、烧杯、铁架台、漏斗等,故完成步骤Ⅳ的实验操作还需要选择的玻璃仪器是漏斗;
(4)氢气、一氧化碳易燃,用其还原氧化铜存在不安全因素,用碳还原氧化铜,所得铜中易混有炭粉。故从安全角度考虑,方案甲、乙不好;从产品纯度考虑,方案丙不好。

 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案