题目内容
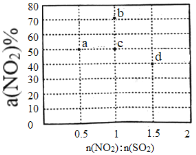
【题目】一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示:下列描述正确的是

A. 反应开始到10s,用Z表示的反应速率为0.158mol/(L·s)
B. 平衡时的压强是起始压强的1.2倍
C. 反应开始到10s时,Y的转化率为79.0%
D. 反应的化学方程式为:X(g)+ Y(g)![]() Z(g)
Z(g)
【答案】C
【解析】
A.根据图像可知,0~10s内,Z的反应速率v(Z)=1.58mol÷2L÷10s=0.079mol/(L·s),故A错误;
B.化学方程式为X+Y![]() 2Z,该反应是一个前后体积不变的反应,反应前后压强不变,故B错误;
2Z,该反应是一个前后体积不变的反应,反应前后压强不变,故B错误;
C.根据图像可知,0~10s内,Y的物质的量由1mol减少到0.21mol,转化率为(1mol-0.21mol)/1mol×100%=79%,故C正确;
D.据曲线图可判断出X、Y为反应物、Z为生成物,且该反应为可逆反应。从反应开始到10s末,Δn(X)=1.20mol-0.41mol=0.79mol,Δn(Y)=1.00mol-0.21mol=0.79mol,Δn(Z)=1.58mol,所以化学方程式为X+Y![]() 2Z,故D错误。
2Z,故D错误。
故选C。

练习册系列答案
 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案
相关题目