题目内容
【题目】有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示。E的单质可与酸反应,1 mol E单质与足量酸作用,在标准状况下能产生33.6 L H2;E的阳离子与A的阴离子核外电子层结构完全相同,回答下列问题:

(1)五种元素的名称:A________,B________,C________,D________,E________。
(2)画出C原子、A离子的结构示意图:__________________、__________________。
(3)B单质在D单质中燃烧,反应现象是_______________________,生成物的化学式为_____________________。
(4)A与E形成化合物的化学式为______________,它的性质决定了它在物质的分类中应属于__________________。
(5)向D与E形成的化合物的水溶液中滴入烧碱溶液直至无明显现象发生时,观察到的现象是先有白色胶状沉淀产生并逐渐增多,随NaOH加入又逐渐溶解最终澄清,请写出有关反应的离子方程式为_______________________、___________________________________________。
【答案】氧 磷 硫 氯 铝 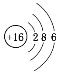
![]() 白色烟雾 PCl3、PCl5 Al2O3 两性氧化物 Al3++3OH-=Al(OH)3↓ Al(OH)3+OH-=AlO2-+2H2O
白色烟雾 PCl3、PCl5 Al2O3 两性氧化物 Al3++3OH-=Al(OH)3↓ Al(OH)3+OH-=AlO2-+2H2O
【解析】
A、B、C、D、E五种短周期元素,由位置图可知,A在第二周期,B、C、D处于第三周期,设C的质子数为x,则A的质子数为x-8,B的质子数为x-1,D的质子数为x+1,A、B、C、D四种元素原子核外共有56个电子,则x+(x-8)+(x-1)+(x+1)=56,解得x=16,即A为O,B为P,C为S,D为Cl;1molE单质与足量酸作用,在标准状况下能产生33.6LH2,设E的化合价为y,根据电子转移守恒:1mol×y=![]() ×2×1,解得y=3,E的阳离子与A的阴离子核外电子层结构完全相同,则E为Al,据此解答。
×2×1,解得y=3,E的阳离子与A的阴离子核外电子层结构完全相同,则E为Al,据此解答。
(1)由上述分析,可知A为氧、B为磷、C为硫、D为氯、E为铝;
(2)C为硫,S原子核外有16个电子,三个电子层,各层电子数为2、8、6,原子结构示意图为: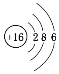 ;A为氧,O2-离子核外电子数为10,有2个电子层,各层电子数为2、8,离子结构示意图为:
;A为氧,O2-离子核外电子数为10,有2个电子层,各层电子数为2、8,离子结构示意图为: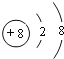 ;
;
(3)磷单质在氯气中燃烧三氯化磷和五氯化磷,生成物的化学式为:PCl3是液体、PCl5是固体,反应现象是:有白色烟雾生成;
(4)A与E形成的化合物为氧化铝,化学式为Al2O3,能与酸、碱反应生成盐与水,属于两性氧化物;
(5)D与E形成的化合物为AlCl3,向AlCl3的水溶液中逐渐滴入烧碱溶液直至过量,发生Al3++3OH-=Al(OH)3↓、Al(OH)3+OH-=AlO2-+2H2O,则可观察到先有白色胶状沉淀产生并逐渐增多,随NaOH加入又逐渐溶解最终澄清。

 名校课堂系列答案
名校课堂系列答案【题目】在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下(已知![]()
![]() kJ·mol
kJ·mol![]() )下列说法正确的是
)下列说法正确的是
容器 | 甲 | 乙 | 丙 |
反应物投入量 | 1mol N2、3mol H2 | 2mol NH3 | 4mol NH3 |
NH3的浓度(mol·L | c1 | c2 | c3 |
反应的能量变化 | 放出akJ | 吸收bkJ | 吸收ckJ |
体系压强(Pa) | p1 | p2 | p3 |
反应物转化率 |
|
|
|
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()



