题目内容
已知下列热化学方程式:
(1)CH3COOH(l) + 2O2(g) ="=" 2CO2(g) + 2H2O(l) △H1=" -870.3" kJ·mol-1
(2)C(s) + O2(g) ="=" CO2(g) △H2=" -393.5" kJ·mol-1
(3)H2(g) + 1/2 O2(g) ="=" H2O(l) △H3= -285.8kJ·mol-1
则反应:2C(s) + 2H2(g) + O2(g) ="=" CH3COOH(l)的反应热为( )
(1)CH3COOH(l) + 2O2(g) ="=" 2CO2(g) + 2H2O(l) △H1=" -870.3" kJ·mol-1
(2)C(s) + O2(g) ="=" CO2(g) △H2=" -393.5" kJ·mol-1
(3)H2(g) + 1/2 O2(g) ="=" H2O(l) △H3= -285.8kJ·mol-1
则反应:2C(s) + 2H2(g) + O2(g) ="=" CH3COOH(l)的反应热为( )
| A.-488.3 kJ·mol-1 | B.-244.15 kJ·mol-1 | C.+488.3 kJ·mol-1 | D.+244.15 kJ·mol-1 |
A
考查反应热的有关计算。根据盖斯定律可知,(2)×2+(3)×2-(1)即得到2C(s) + 2H2(g) + O2(g) ="=" CH3COOH(l),所以该反应的△H=-393.5 kJ·mol-1×2-285.8kJ·mol-1×2+870.3 kJ·mol-1=-488.3 kJ·mol-1 ,答案选A。

练习册系列答案
相关题目
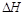 =______________。
=______________。  O2(g)
O2(g) CO(g) ΔH1 = —110.5 kJ/mol
CO(g) ΔH1 = —110.5 kJ/mol