题目内容
6.若将16g铜与足量的浓硫酸在加热时发生反应,铜完全溶解,则消耗的硫酸的物质的量是多少.分析 根据n=$\frac{m}{M}$计算Cu的物质的量,根据Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O计算消耗的硫酸的物质的量.
解答 解:16gCu的物质的量为$\frac{16g}{64g/mol}$=0.25mol,根据Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O可知,消耗的硫酸的物质的量为0.25mol×2=0.5mol,
答:消耗硫酸的物质的量为0.5mol.
点评 本题考查根据方程式的计算,比较基础,旨在考查学生对基础知识的理解掌握,明确Cu与浓硫酸之间的反应方程式是解题的关键.

练习册系列答案
相关题目
16.下列物质不能使酸性KMnO4溶液褪色的是( )
| A. | 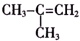 | B. | C2H2 | C. |  | D. |  |
17.“雾霾”成为2013年的年度关键词,下列措施不能消除雾霾的是( )
| A. | 机动车安装尾气净化器 | |
| B. | 改变用燃烧方式使植物变肥料的方法 | |
| C. | 开发新能源,减少化石燃料的使用 | |
| D. | 提议将所有发电厂、化工厂搬迁到郊区 |
14.下列有机物分子中,所有原子不可能处于同一平面的是( )
| A. |  | B. | CH2=CH-CH=CH2 | C. | 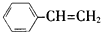 | D. | 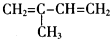 |
1.下列金属治炼的反应原理,错误的是( )
| A. | 2NaCl(熔融)$\frac{\underline{\;电解\;}}{\;}$2Na+Cl2↑ | B. | 2HgO$\frac{\underline{\;\;△\;\;}}{\;}$2Hg+O2↑ | ||
| C. | Fe3O4+3CO$\frac{\underline{\;高温\;}}{\;}$3Fe+3CO2 | D. | MgO+H2$\frac{\underline{\;\;△\;\;}}{\;}$Mg+H2O |
11.下列关于糖类、油脂、蛋白质的说法中正确的是( )
| A. | 馒头、米饭在口腔内越嚼越甜,是因为它们含有的淀粉发生了酯化反应 | |
| B. | 糖类、油脂、蛋白质都是高分子化合物 | |
| C. | 油脂在人体内酶的作用下可水解成甘油和高级脂肪酸 | |
| D. | 油脂、蛋白质都只是由C,H,O三种元素组成的 |
18.易燃、易爆、有毒等物质的包装上应贴L:危险警告标识.下面所列物质贴错了标识的是( )
| A | B | C | D | |
| 物质的化学式 | CCl4 | NaOH | CH3OH | NH4NO3 |
| 危险警告标识 | 易燃品 | 腐蚀品 | 有毒品 | 爆炸品 |
| A. | A | B. | B | C. | C | D. | D |
15.下列说法不正确的是( )
| A. | 石油破裂的主要目的是得到乙烯 | |
| B. | 有机物结构的分析方法有核磁共振法、红外光谱法、质谱法和紫外光谱法等 | |
| C. | 李比希提出基团的概念,并首次使用无机盐合成尿素,突破了有机物与无机物的界限 | |
| D. | 糖类、油脂、蛋白质是人类重要营养物质 |
16.瓦斯爆炸是煤矿开采中的重大危害,一种瓦斯分析仪(图甲)的传感器在煤矿巷道中的甲烷达到一定浓度时可以显示示.该瓦斯分析仪工作原理类似燃料电池的工作原理,其装置如图乙所示,其中的固体电解质是Y2O3-Na2O,O2-可以在其中自由移动.下列有关叙述不正确的是,( )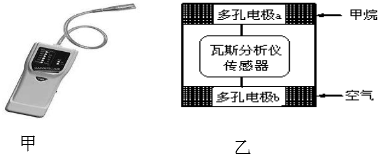

| A. | 电极b是正极,内电路中O2-由电极b流向电极a | |
| B. | 电极a的反应式为:CH4+4O2--8e-═CO2+2H2O | |
| C. | 瓦斯分析仪工作时,电池内电路中电子由电极b流向电极a | |
| D. | 当固体电解质中有1mol O2-通过时,电子转移2mol |