题目内容
17.“雾霾”成为2013年的年度关键词,下列措施不能消除雾霾的是( )| A. | 机动车安装尾气净化器 | |
| B. | 改变用燃烧方式使植物变肥料的方法 | |
| C. | 开发新能源,减少化石燃料的使用 | |
| D. | 提议将所有发电厂、化工厂搬迁到郊区 |
分析 根据雾霾天气形成,其原因有城市汽车数量剧增,排放大量尾气,工业生产、田间焚烧秸秆及冬季取暖排放的粉尘、硫氧化合物等PM2.5颗粒物增多等.
解答 解:A.安装尾气净化器可减少污染气体的排放,故A正确;
B.燃烧会产生气体污染,故B正确;
C.新能源是清洁能源,可减少污染气体的排放,故C正确;
D.发电厂、化工厂搬迁到郊区不减少污染气体总量,故D错误.
故选D.
点评 本题主要考查了雾霾成因,难度不大,注意知识的总结与归纳.

练习册系列答案
相关题目
7.下列各组物质中,互为同系物的是( )
| A. | CH4和CH3CH2CH3 | B. | ${\;}_{17}^{35}$Cl和${\;}_{17}^{37}$Cl | ||
| C. | 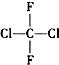 和 和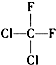 | D. |  和CH3-CH2-CH2-CH3 和CH3-CH2-CH2-CH3 |
8.贵州开磷(集团)有限责任公司按照循环经济的发展理念,将工业合成氨与制备甲醇进行联合生产,现已具备年产60万吨合成氨、38万吨甲醇的生产能力.其生产流程如图1:
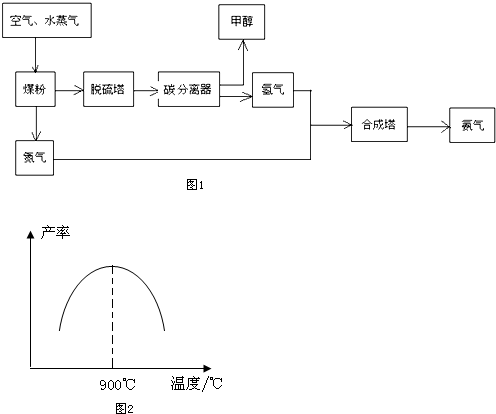
请回答下列问题:
(1)工业生产时,水蒸气可与煤粉反应制备H2,反应的化学方程式为C+H2O(g)$\frac{\underline{\;高温\;}}{\;}$CO+H2;
(2)工业制取氢气的另一个反应为:CO+H2O(g)?CO2+H2.在T℃时,往1L密闭容器中充入0.2molCO和0.3mol水蒸气,反应达平衡后,体系中c(H2)═0.12mol•L-1.该温度下此反应的平衡常数K=1(填计算结果);
(3)若在恒温恒容的容器内进行反应CO(g)+2H2 (g)?C H3OH(g),在密闭容器中开始只加入CO、H2,反应10min后测得各组分的浓度如下:
①该时间段内反应速率v(H2)=0.08mol/(L•min);
②该反应达到平衡状态的标志是BC(填字母序号);
A.有1个H-H键生成的同时有3个C-H键生成
B.CO的百分含量保持不变
C.容器中混合气体的压强不变化
D.容器中混合气体的密度不变化
(4)已知在常温常压下:
①2C H3OH(l)+3O2 (g)?2CO2 (g)+4H2 O(g)△H1=-1275.6kJ/mol
②2C O(l)+O2 (g)?2CO2 (g)△H2=-566.0kJ/mol
③H2O (g)?H2 O(l)△H3=-44.0kJ/mol
写出甲醇不完燃烧生成一氧化碳和液态水的热化学方程式CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8kJ•mol-1;
(5)N2和H2以铁作催化剂从145℃就开始反应,不同温度下NH3的产率如图2所示.温度高于900℃时,NH3产率下降的原因是温度高于900℃时,平衡向左移动;生产过程中合成气要进行循环,其目的是提高原料的利用率.

请回答下列问题:
(1)工业生产时,水蒸气可与煤粉反应制备H2,反应的化学方程式为C+H2O(g)$\frac{\underline{\;高温\;}}{\;}$CO+H2;
(2)工业制取氢气的另一个反应为:CO+H2O(g)?CO2+H2.在T℃时,往1L密闭容器中充入0.2molCO和0.3mol水蒸气,反应达平衡后,体系中c(H2)═0.12mol•L-1.该温度下此反应的平衡常数K=1(填计算结果);
(3)若在恒温恒容的容器内进行反应CO(g)+2H2 (g)?C H3OH(g),在密闭容器中开始只加入CO、H2,反应10min后测得各组分的浓度如下:
| 物质 | H2 | CO | C H3OH |
| 浓度/(mol•L-1) | 0.20 | o.10 | o.40 |
②该反应达到平衡状态的标志是BC(填字母序号);
A.有1个H-H键生成的同时有3个C-H键生成
B.CO的百分含量保持不变
C.容器中混合气体的压强不变化
D.容器中混合气体的密度不变化
(4)已知在常温常压下:
①2C H3OH(l)+3O2 (g)?2CO2 (g)+4H2 O(g)△H1=-1275.6kJ/mol
②2C O(l)+O2 (g)?2CO2 (g)△H2=-566.0kJ/mol
③H2O (g)?H2 O(l)△H3=-44.0kJ/mol
写出甲醇不完燃烧生成一氧化碳和液态水的热化学方程式CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8kJ•mol-1;
(5)N2和H2以铁作催化剂从145℃就开始反应,不同温度下NH3的产率如图2所示.温度高于900℃时,NH3产率下降的原因是温度高于900℃时,平衡向左移动;生产过程中合成气要进行循环,其目的是提高原料的利用率.
12.下列氧化反应属于吸热反应的是( )
| A. | 二氧化碳与赤热的炭反应生成一氧化碳 | |
| B. | 葡萄糖在人体内氧化分解 | |
| C. | 锌粒与稀H2SO4反应制取H2 | |
| D. | Ba(OH)2•8H2O与NH4Cl反应 |
2.下列有关电解质溶液中粒子浓度关系正确的是( )
| A. | CO2的水溶液中:c(H+)>c(HCO3-)═2c(CO32-) | |
| B. | pH=1的NaHSO4溶液:c(H+)═c(SO42-)十c(OH-) | |
| C. | 含有AgCl和AgI固体的悬浊液:c(Ag+)>c(C1-)═c(I-) | |
| D. | 等物质的量浓度的NH4HSO4溶液和NH4Cl溶液,c(NH4+)前者小 |
9.下列化合物中同分异构体数目最多的是( )
| A. | 戊烷 | B. | 戊烯 | C. | 戊醇 | D. | 戊酸 |
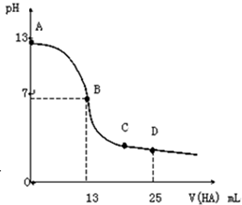 常温下,向25mL0.1mol•L-1MOH溶液中逐滴加入0.2mol•L-1HA溶液,曲线如图所示(体积变化忽略不计).回答下列问题:
常温下,向25mL0.1mol•L-1MOH溶液中逐滴加入0.2mol•L-1HA溶液,曲线如图所示(体积变化忽略不计).回答下列问题: