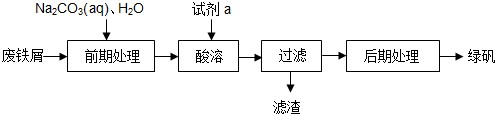
题目内容
20.己知下列三个化学反应:①3Cl2+6NaOH═5NaCl+NaClO3+3H2O ②2CO+C2$\frac{\underline{\;点燃\;}}{\;}$2CO2 ③MnO2+4HCl═MnCl2+Cl2↑+2H2O
(1)反应①中被氧化与被还原的氯元素的质量之比为1:5;
(2)反应②中被还原的元素是O;
(3)反应③中被氧化和未被氧化的Cl-的个数比为1:1.
分析 (1)反应①中只有Cl元素化合价发生变化;
(2)反应②中C元素化合价升高,O元素化合价降低;
(3)反应③中Mn元素化合价降低,Cl元素化合价升高.
解答 解:(1)反应①中只有Cl元素化合价发生变化,Cl元素化合价由0价分别分别变化为+5价、-1价,被氧化与被还原的氯元素的质量之比为1:5,故答案为:1:5;
(2)反应②中C元素化合价升高,O元素化合价降低,被还原的元素为O,故答案为:O;
(3)反应③中Mn元素化合价降低,Cl元素化合价升高,由方程式可知当有4molHCl参加反应,有2mol被氧化,被氧化和未被氧化的Cl-的个数比为1:1,
故答案为:1:1.
点评 本题综合考查氧化还原反应,为高频考点,侧重于学生的分析、计算能力的考查,注意把握氧化还原反应的相关概念与化合价的关系,难度不大.

练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
相关题目
10.将BaO2放入密闭的真空容器中,反应2BaO2(s)═2BaO(s)+O2(g)达到平衡.保持温度不变,缩小容器容积,体系重新达到平衡,下列说法正确的是( )
| A. | 平衡常数减小 | B. | O2浓度增加 | C. | O2压强不变 | D. | BaO量不变 |
8.在温度,容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:[已知2CO(g)+O2(g)?2CO2(g)△H=-566.0KJ/mol-1]
下列关系不正确的是( )
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 2mol CO、1mol O2 | 2mol CO2 | 4mol CO2 |
| CO2的浓度(mol•L-1) | C1 | C2 | C3 |
| 反应的能量变化 | 放出aKJ | 吸收bKJ | 吸收CkJ |
| 体系压强(Pa) | P1 | P2 | P3 |
| A. | 2c1<c3 | B. | a+b=283.0 | C. | 2p2>p3 | D. | c1=c2 |
5.在0.5L某浓度的NaCl溶液中含有0.5molNa+,下列对该溶液中的说法中,正确的是( )
①该溶液的物质的量浓度为1mol•L-1
②该溶液中含有58.5g NaCl
③配制100mL该溶液需用58.5g NaCl
④量取100mL该溶液倒入烧杯中,烧杯中Cl-的物质的量为0.1mol.
①该溶液的物质的量浓度为1mol•L-1
②该溶液中含有58.5g NaCl
③配制100mL该溶液需用58.5g NaCl
④量取100mL该溶液倒入烧杯中,烧杯中Cl-的物质的量为0.1mol.
| A. | ①② | B. | ②④ | C. | ②③④ | D. | ①④ |
12.列有关Na2C03和NaC03性质的比较中正确的是( )
| A. | 等浓度的溶液中滴入稀盐酸.放出气体的快慢Na2C03<NaC03 | |
| B. | 热稳定性Na2C03<NaHC03 | |
| C. | 常温时水溶性Na2C03<NaHC03 | |
| D. | 相对分子质量Na2C03<NaHC03 |
14.用1-丁醇、溴化钠和较浓H2SO4混合物为原料,在实验室制备1-溴丁烷,并检验反应的部分副产物.(已知:NaCl+H2SO4(浓)=NaHSO4+HCl↑)现设计如下装置,其中夹持仪器、加热仪器及冷却水管没有画出.请回答下列问题:
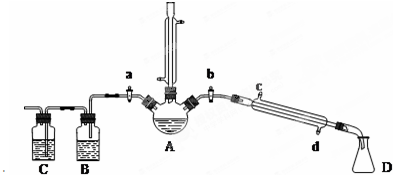
(1)仪器A的名称是三颈烧瓶.
(2)关闭a和b、接通竖直冷凝管的冷凝水,给A加热30分钟,制备1-溴丁烷.写出该反应的化学方程式三颈烧瓶.
(3)理论上,上述反应的生成物还可能有:丁醚、1-丁烯、溴化氢等.熄灭A处酒精灯,在竖直冷凝管上方塞上塞子,打开a,利用余热继续反应直至冷却,通过B、C装置检验部分副产物.B、C中应盛放的试剂分别是硝酸银、高锰酸钾溶液或溴水.
(4)在实验过程中,发现A中液体由无色逐渐变成黑色,该黑色物质与浓硫酸反应的化学方程式为C+2H2SO4(浓) $\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O,可在竖直冷凝管的上端连接一个内装吸收剂碱石灰的干燥管,以免污染空气.
(5)相关有机物的数据如下:
为了进一步精制1-溴丁烷,继续进行了如下实验:待烧瓶冷却后,拔去竖直的冷凝管,塞上带温度计的橡皮塞,关闭a,打开b,接通冷凝管的冷凝水,使冷水从d(填c或d)处流入,迅速升高温度至101.6℃,收集所得馏分.
(6)若实验中所取1-丁醇、NaBr分别为7.4g、13.0g,蒸出的粗产物经洗涤、干燥后再次蒸馏得到9.6g 1-溴丁烷,则1-溴丁烷的产率是.

(1)仪器A的名称是三颈烧瓶.
(2)关闭a和b、接通竖直冷凝管的冷凝水,给A加热30分钟,制备1-溴丁烷.写出该反应的化学方程式三颈烧瓶.
(3)理论上,上述反应的生成物还可能有:丁醚、1-丁烯、溴化氢等.熄灭A处酒精灯,在竖直冷凝管上方塞上塞子,打开a,利用余热继续反应直至冷却,通过B、C装置检验部分副产物.B、C中应盛放的试剂分别是硝酸银、高锰酸钾溶液或溴水.
(4)在实验过程中,发现A中液体由无色逐渐变成黑色,该黑色物质与浓硫酸反应的化学方程式为C+2H2SO4(浓) $\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O,可在竖直冷凝管的上端连接一个内装吸收剂碱石灰的干燥管,以免污染空气.
(5)相关有机物的数据如下:
| 物质 | 熔点/0C | 沸点/0C |
| 1-丁醇 | -89.5 | 117.3 |
| 1-溴丁烷 | -112.4 | 101.6 |
| 丁醚 | -95.3 | 142.4 |
| 1-丁烯 | -185.3 | -6.5 |
(6)若实验中所取1-丁醇、NaBr分别为7.4g、13.0g,蒸出的粗产物经洗涤、干燥后再次蒸馏得到9.6g 1-溴丁烷,则1-溴丁烷的产率是.