题目内容
13.绿矾(FeSO4•7H2O)是一种重要的食品和饲料添加剂.在实验室里可以通过下列流程用废铁屑制备绿矾: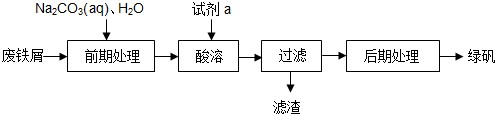
完成下列填空:
(1)试剂a是稀H2SO4(填写化学式);
(2)酸溶时发生的主要反应的化学方程式为Fe+H2SO4=H2↑+FeSO4;
(3)上述过程中的过滤操作所用的主要玻璃仪器有玻璃棒、漏斗、烧杯.
(4)利用如图装置对所获产品(FeSO4•nH2O)中结晶水的含量进行测定.

反应前称量C中的硬质玻璃管(82.112g)、装入晶体后的硬质玻璃管(86.282g)、D的质量(78.368g).反应后称得C中硬质玻璃管的质量为84.432g,D的质量为80.474g.产品硫酸亚铁晶体(FeSO4•nH2O)中n=6.7(小数点后保留1位有效数字).
分析 废铁屑加入碳酸钠溶液除去油污,加入硫酸酸溶后,为了防止亚铁离子被氧化,加入的硫酸应适量保证铁少量剩余,过滤时滤渣中一定含有Fe,滤液通过蒸发浓缩,冷却结晶,过滤洗涤得到绿矾晶体;
(1)要制备硫酸亚铁,所以要用稀硫酸溶解铁屑,为了防止亚铁离子被氧化,Fe不能全部消耗;
(2)酸溶时是铁和硫酸反应生成硫酸亚铁和氢气;
(3)依据过滤装置和步骤分析选择玻璃仪器;
(4)根据已知数据求出水的质量和晶体的质量,根据二者的物质的量关系求出n.
解答 解:(1)要制备硫酸亚铁,所以要用稀硫酸溶解铁屑,为了防止亚铁离子被氧化,Fe不能全部消耗,则加入稀硫酸时当溶液中气泡较少时即停止加硫酸,防止Fe被耗尽;
故答案为:稀H2SO4;
(2)酸溶时发生的主要反应是铁和硫酸反应生成硫酸亚铁和氢气,反应的化学方程式为:Fe+H2SO4=H2↑+FeSO4;
故答案为:Fe+H2SO4=H2↑+FeSO4;
(3)利用漏斗、玻璃棒、烧杯组装过滤装置进行过滤操作,所用的主要玻璃仪器有玻璃棒、漏斗、烧杯;
故答案为:漏斗;
(4)通过以上数据得出,晶体质量为86.282g-82.112=4.170g,加热完全分解后剩余固体的质量为84.432g-82.112=2.320g,
所以$\frac{18n}{152}$=$\frac{4.170-2.320}{2.320}$,解得n=6.7,
故答案为:6.7.
点评 本题考查较为综合,涉及化学实验方案的评价以及相关计算等知识,侧重于学生的分析能力、实验能力、计算能力的考查,注意相关基础知识的积累,难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
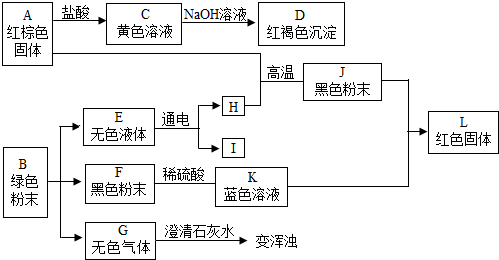
5. 实验室制备1,2-二溴乙烷的反应原理如下:
实验室制备1,2-二溴乙烷的反应原理如下:
①CH3CH2OH②$→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2↑+H2O
②CH2=CH2+Br2→BrCH2CH2Br
可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚.用16.0g的溴和足量的乙醇制备1,2-二溴乙烷,实验结束后得到9.4g产品.实验装置如图所示:有关数据列表如下:
请回答下列问题:
(1)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其主要目的是d;(填正确选项前的字母)
a、引发反应b、加快反应速度c、防止乙醇挥发d、减少副产物乙醚生成
(2)在装置C中应加入c,其目的是吸收反应中可能生成的酸性气体;(填正确选项前的字母)
a、水b、浓硫酸c、氢氧化钠溶液d、酸性KMnO4溶液
(3)判断该制备反应已经结束的最简单的方法是溴的颜色完全褪去.
(4)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在下层(填“上”或“下”);
(5)在装置B中较长玻璃导管的作用是防止倒吸、判断装置是否堵塞;
(6)反应过程中应用冷水冷却装置D,其主要目的是乙烯与溴反应时放热,冷却可避免溴的大量挥发,但又不能过度冷却(如用冰水),其原因是1,2-二溴乙烷的凝固点较低(9℃),过度冷却会使其凝固而使气路堵塞;
(7)本实验中,1,2-二溴乙烷的产率为50%.
 实验室制备1,2-二溴乙烷的反应原理如下:
实验室制备1,2-二溴乙烷的反应原理如下:①CH3CH2OH②$→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2↑+H2O
②CH2=CH2+Br2→BrCH2CH2Br
可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚.用16.0g的溴和足量的乙醇制备1,2-二溴乙烷,实验结束后得到9.4g产品.实验装置如图所示:有关数据列表如下:
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/0C | 78.5 | 132 | 34.6 |
| 熔点/0C | -130 | 9 | -116 |
| 溶解性 | 易溶水 | 难溶水 | 微溶于水 |
(1)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其主要目的是d;(填正确选项前的字母)
a、引发反应b、加快反应速度c、防止乙醇挥发d、减少副产物乙醚生成
(2)在装置C中应加入c,其目的是吸收反应中可能生成的酸性气体;(填正确选项前的字母)
a、水b、浓硫酸c、氢氧化钠溶液d、酸性KMnO4溶液
(3)判断该制备反应已经结束的最简单的方法是溴的颜色完全褪去.
(4)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在下层(填“上”或“下”);
(5)在装置B中较长玻璃导管的作用是防止倒吸、判断装置是否堵塞;
(6)反应过程中应用冷水冷却装置D,其主要目的是乙烯与溴反应时放热,冷却可避免溴的大量挥发,但又不能过度冷却(如用冰水),其原因是1,2-二溴乙烷的凝固点较低(9℃),过度冷却会使其凝固而使气路堵塞;
(7)本实验中,1,2-二溴乙烷的产率为50%.
3.下列关于烃的说法中正确的是( )
| A. | 烷烃不能发生加成反应,烯烃不能发生取代反应 | |
| B. | 烷烃中含饱和键、烯烃、炔烃中含不饱和键 | |
| C. | 能发生加成反应的一定是烯烃 | |
| D. | 符合通式CnH2n+2的一定是烷烃,符合通式CnH2n的一定是烯烃. |
 l,2二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,密度2.189cm-3,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂.在实验室中可用下列反应制备1,2二溴乙烷.
l,2二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,密度2.189cm-3,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂.在实验室中可用下列反应制备1,2二溴乙烷.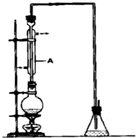 溴乙烷是一种重要的有机化工原料,其沸点为38.4℃.制备溴乙烷的一种方法是乙醇与氢溴酸反应.某课外小组欲在实验室制备溴乙烷的装置如右图,实验操怍步骤如下:
溴乙烷是一种重要的有机化工原料,其沸点为38.4℃.制备溴乙烷的一种方法是乙醇与氢溴酸反应.某课外小组欲在实验室制备溴乙烷的装置如右图,实验操怍步骤如下: