题目内容
11.在相同状况下,一个空瓶,若装满N2称其质量为36g,若装满NO称其质量为40g,装满A气体,称其质量为44g,则A的相对分子质量是32.分析 氮气体积与NO、气体A的体积相等,相同条件下三者物质的量相等,假设气体物质的量为x,氮气与NO质量之差=装满NO气体时质量-装满氮气时质量,据此计算气体的物质的量,而氧气与NO质量之差=装满氧气时质量-装满NO时质量,进而计算A的相对分子质量.
解答 解:氮气体积与NO、气体A的体积相等,相同条件下三者物质的量相等,假设气体物质的量为x,则:
xmol×(30g/mol-28g/mol)=40g-36g,
解得x=2,
令A的相对分子质量则y,则:
2mol×(yg/mol-30g/mol)=44g-40g,
解得y=32,
故答案为:32.
点评 本题考查阿伏加德罗定律及其推论,注重基础知识的考查,题目难度不大.

练习册系列答案
 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案
相关题目
6.下列叙述正确的是 ( )
| A. | H+的摩尔质量是1g | B. | H+的摩尔质量是1g/mol | ||
| C. | H+的摩尔质量是1 | D. | H+的摩尔质量是1mol |
16.物质的量浓度相同的NaCl溶液和NaClO溶液中,下列关系中正确的是( )
| A. | NaCl溶液中离子的总浓度和NaClO溶液中离子的总浓度相等 | |
| B. | NaCl溶液中离子的总浓度大于NaClO溶液中离子的总浓度 | |
| C. | NaCl溶液中离子的总浓度小于NaClO溶液中离子的总浓度 | |
| D. | NaCl溶液的pH大于NaClO溶液的pH |
3.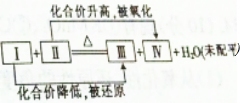 一个化学反应体系中含有浓H2SO4,Cu,H2O,CuSO4,SO2 5种物质,其发生反应的化学方程式可用如图表示,则Ⅳ处的物质是( )
一个化学反应体系中含有浓H2SO4,Cu,H2O,CuSO4,SO2 5种物质,其发生反应的化学方程式可用如图表示,则Ⅳ处的物质是( )
 一个化学反应体系中含有浓H2SO4,Cu,H2O,CuSO4,SO2 5种物质,其发生反应的化学方程式可用如图表示,则Ⅳ处的物质是( )
一个化学反应体系中含有浓H2SO4,Cu,H2O,CuSO4,SO2 5种物质,其发生反应的化学方程式可用如图表示,则Ⅳ处的物质是( )| A. | H2SO4 | B. | CuSO4 | C. | Cu | D. | SO2 |
5.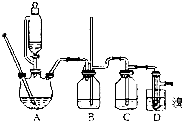 实验室制备1,2-二溴乙烷的反应原理如下:
实验室制备1,2-二溴乙烷的反应原理如下:
①CH3CH2OH②$→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2↑+H2O
②CH2=CH2+Br2→BrCH2CH2Br
可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚.用16.0g的溴和足量的乙醇制备1,2-二溴乙烷,实验结束后得到9.4g产品.实验装置如图所示:有关数据列表如下:
请回答下列问题:
(1)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其主要目的是d;(填正确选项前的字母)
a、引发反应b、加快反应速度c、防止乙醇挥发d、减少副产物乙醚生成
(2)在装置C中应加入c,其目的是吸收反应中可能生成的酸性气体;(填正确选项前的字母)
a、水b、浓硫酸c、氢氧化钠溶液d、酸性KMnO4溶液
(3)判断该制备反应已经结束的最简单的方法是溴的颜色完全褪去.
(4)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在下层(填“上”或“下”);
(5)在装置B中较长玻璃导管的作用是防止倒吸、判断装置是否堵塞;
(6)反应过程中应用冷水冷却装置D,其主要目的是乙烯与溴反应时放热,冷却可避免溴的大量挥发,但又不能过度冷却(如用冰水),其原因是1,2-二溴乙烷的凝固点较低(9℃),过度冷却会使其凝固而使气路堵塞;
(7)本实验中,1,2-二溴乙烷的产率为50%.
 实验室制备1,2-二溴乙烷的反应原理如下:
实验室制备1,2-二溴乙烷的反应原理如下:①CH3CH2OH②$→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2↑+H2O
②CH2=CH2+Br2→BrCH2CH2Br
可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚.用16.0g的溴和足量的乙醇制备1,2-二溴乙烷,实验结束后得到9.4g产品.实验装置如图所示:有关数据列表如下:
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/0C | 78.5 | 132 | 34.6 |
| 熔点/0C | -130 | 9 | -116 |
| 溶解性 | 易溶水 | 难溶水 | 微溶于水 |
(1)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其主要目的是d;(填正确选项前的字母)
a、引发反应b、加快反应速度c、防止乙醇挥发d、减少副产物乙醚生成
(2)在装置C中应加入c,其目的是吸收反应中可能生成的酸性气体;(填正确选项前的字母)
a、水b、浓硫酸c、氢氧化钠溶液d、酸性KMnO4溶液
(3)判断该制备反应已经结束的最简单的方法是溴的颜色完全褪去.
(4)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在下层(填“上”或“下”);
(5)在装置B中较长玻璃导管的作用是防止倒吸、判断装置是否堵塞;
(6)反应过程中应用冷水冷却装置D,其主要目的是乙烯与溴反应时放热,冷却可避免溴的大量挥发,但又不能过度冷却(如用冰水),其原因是1,2-二溴乙烷的凝固点较低(9℃),过度冷却会使其凝固而使气路堵塞;
(7)本实验中,1,2-二溴乙烷的产率为50%.
 如图是一个化学过程的示意图.已知甲池的总反应式为:2CH3OH+3O2+4KOH═2K2CO3+6H2O.
如图是一个化学过程的示意图.已知甲池的总反应式为:2CH3OH+3O2+4KOH═2K2CO3+6H2O.